1
阿部真也, 他:周産期医学. 2017;47(10):1353-1355
2
齊藤大祐, 他:鹿児島産科婦人科学会雑誌. 2021;29:49-54
3
弘田雄三, 他:臨床医薬. 1992;8(3):507-522
4
弘田雄三, 他:基礎と臨床. 1992;26(4):1457-1468
5
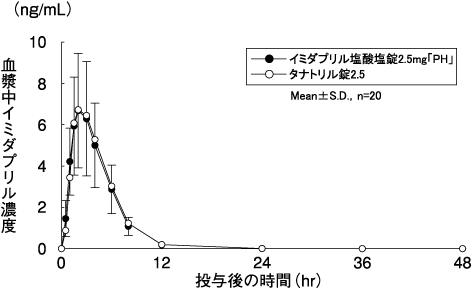
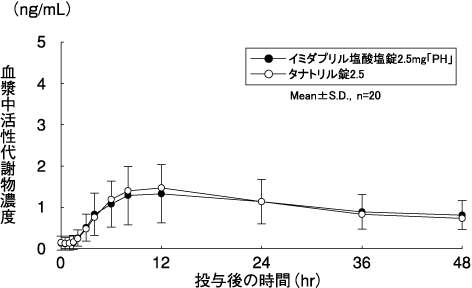
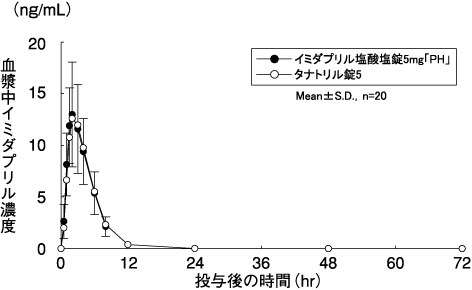
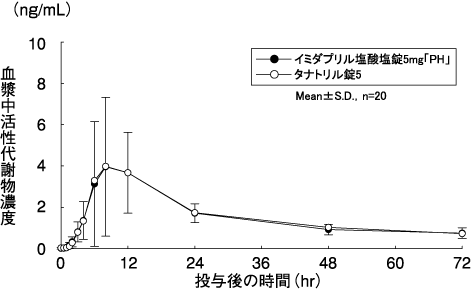
キョーリンリメディオ株式会社社内資料:
イミダプリル塩酸塩錠2.5mg「PH」・5mg「PH」の生物学的同等性試験に関する資料
深澤一郎, 他:診療と新薬. 2008;45(7):677
イミダプリル塩酸塩錠2.5mg「PH」・5mg「PH」の生物学的同等性試験に関する資料
深澤一郎, 他:診療と新薬. 2008;45(7):677
6
Yamada Y, et al.:Arzneimittelforschung. 1992;42(4):466-474
7
Yamada Y, et al.:Arzneimittelforschung. 1992;42(4):457-465
8
Matsuoka, M. et al.:J. Chromatogr. 1992;581:65-73
9
第十八改正日本薬局方解説書 廣川書店. 2021;C664-669
10
鈴木 伸, 他:臨牀と研究. 1992;69(2):636-648
11
石井當男, 他:臨床医薬. 1992;8(2):299-313
12
猿田享男, 他:臨床医薬. 1992;8(3):661-697
13
猿田享男, 他:基礎と臨床. 1991;25(15):4809-4825
14
猿田享男, 他:基礎と臨床. 1992;26(1):363-383
15
国内第Ⅲ相比較試験(タナトリル錠:2002年1月17日承認、申請資料概要ト.Ⅰ)
16
菅谷 健, 他:日薬理誌. 1992;100(1):39-45
17
Kubo M, et al.:Jpn J Pharmacol. 1990;53(2):201-210
18
猿田享男, 他:臨床医薬. 1991;7(10):2205-2219
19
Katoh M, et al.:Eur J Pharmacol. 2000;398(3):381-387
20
STZ誘発糖尿病ラットの腎微小循環に対する作用(タナトリル錠:2002年1月17日承認、申請資料概要ホ.Ⅰ.1.(2))
21
Nishiyama S, et al.:Arzneimittelforschung. 1992;42(4):451-456
22
Kubo M, et al.:Jpn J Pharmacol. 1991;57(4):517-526