1
wistar系ラットにおける胎児毒性及び催奇形性試験(segment Ⅱ)帝王切開及び自然分娩試験並びに次世代試験 投与経路:強制経口投与(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ニ 3.(2).1))
2
澤 充 他:薬理と治療. 1994; 22: 4697-4711
3
ヒトに単回経口投与したときのlevocabastineの吸収、排泄及び代謝(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ヘ 3.(1).2).①)
4
ヒト乳汁中へのlevocabastineの排泄(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ヘ 3.(1).2).③)
5
作用機序(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要イ 1.(2)、ホ 2.)
6
Tasaka K, et al.:Arzneim.-Forsch. /Drug Res. 1993;43:1331-1337
7
ヒスタミンによる気管収縮に対する作用(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ホ 5.(1))
8
モルモットにおける塩酸レボカバスチンのin vivoでの抗ヒスタミン作用、抗セロトニン作用及び抗コリン作用:対照薬との比較(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ホ 2.(1).3))
9
Dechant KL, et al.:Drugs. 1991;41:202-224
10
Kamei C, et al.:J. Pharmacobio - Dyn. 1991;14:467-473
11
亀井 千晃 他:あたらしい眼科. 1994;11:603-605
12
モルモットにおけるヒスタミン及び抗原誘発結膜炎に対するレボカバスチン局所投与の作用(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ホ 1.(2))
13
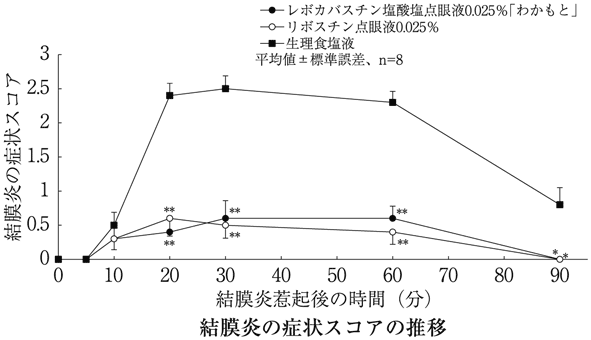
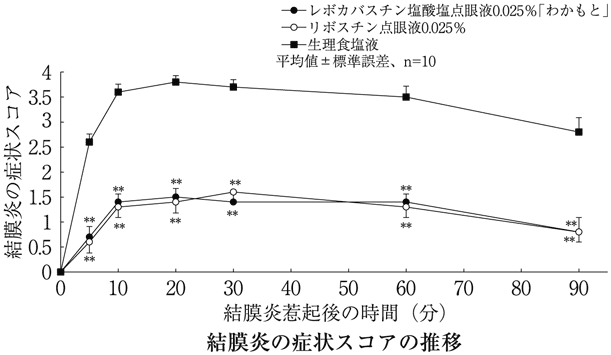
実験的アレルギー性結膜炎に対する塩酸levocabastineの影響(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ホ 1.(3).2)、(4).2))
14
モルモットにおけるhistamine誘発による好中球および好酸球の結膜への浸潤に対する塩酸levocabastine点眼薬の作用(リボスチン点眼液0.025%:2000年9月22日承認、申請資料概要ホ 1.(6))
15
社内資料:生物学的同等性試験