添付文書番号
3999411G4035_1_06
企業コード
300119
作成又は改訂年月
日本標準商品分類番号
87219
薬効分類名
トロンボキサン合成酵素阻害剤
承認等
販売名
オザグレルNa注射液20mgシリンジ「サワイ」
販売名コード
販売名英字表記
OZAGREL Na Injection Syringes [SAWAI]
販売名ひらがな
おざぐれるなとりうむちゅうしゃえき
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
オザグレルNa注射液40mgシリンジ「サワイ」
販売名コード
販売名英字表記
OZAGREL Na Injection Syringes [SAWAI]
販売名ひらがな
おざぐれるなとりうむちゅうしゃえき
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
オザグレルNa注射液80mgシリンジ「サワイ」
販売名コード
販売名英字表記
OZAGREL Na Injection Syringes [SAWAI]
販売名ひらがな
おざぐれるなとりうむちゅうしゃえき
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
一般的名称
オザグレルナトリウム
禁忌(次の患者には投与しないこと)
出血している患者:出血性脳梗塞、硬膜外出血、脳内出血又は原発性脳室内出血を合併している患者[出血を助長する可能性がある。]
重篤な意識障害を伴う大梗塞の患者、脳塞栓症の患者[出血性脳梗塞が発現しやすい。]
本剤の成分に対し過敏症の既往歴のある患者
組成・性状
組成
オザグレルNa注射液20mgシリンジ「サワイ」
有効成分 | 日局オザグレルナトリウム 20mg |
|---|
添加剤 | pH調節剤 |
|---|
オザグレルNa注射液40mgシリンジ「サワイ」
有効成分 | 日局オザグレルナトリウム 40mg |
|---|
添加剤 | pH調節剤 |
|---|
オザグレルNa注射液80mgシリンジ「サワイ」
有効成分 | 日局オザグレルナトリウム 80mg |
|---|
添加剤 | pH調節剤 |
|---|
製剤の性状
オザグレルNa注射液20mgシリンジ「サワイ」
| pH | 8.6~9.6 |
|---|
| 浸透圧比 | 0.4~0.5(生理食塩液に対する比) |
|---|
| 剤形・性状 | 無色澄明の注射液 |
|---|
オザグレルNa注射液40mgシリンジ「サワイ」
| pH | 8.6~9.6 |
|---|
| 浸透圧比 | 0.4~0.5(生理食塩液に対する比) |
|---|
| 剤形・性状 | 無色澄明の注射液 |
|---|
オザグレルNa注射液80mgシリンジ「サワイ」
| pH | 8.6~9.6 |
|---|
| 浸透圧比 | 0.4~0.5(生理食塩液に対する比) |
|---|
| 剤形・性状 | 無色澄明の注射液 |
|---|
効能又は効果
用法及び用量
〈クモ膜下出血術後の脳血管攣縮およびこれに伴う脳虚血症状の改善〉
通常成人に、オザグレルナトリウムとして1日量80mgを適当量の電解質液または糖液で希釈し、24時間かけて静脈内に持続投与する。投与はクモ膜下出血術後早期に開始し、2週間持続投与することが望ましい。なお、年齢、症状により適宜増減する。
〈脳血栓症(急性期)に伴う運動障害の改善〉
通常成人に、オザグレルナトリウムとして1回量80mgを適当量の電解質液または糖液で希釈し、2時間かけて1日朝夕2回の持続静注を約2週間行う。なお、年齢、症状により適宜増減する。
重要な基本的注意
本剤の投与により出血性脳梗塞、硬膜外出血、脳内出血を助長する可能性があるので、救急処置のとれる準備を行い投与すること。また、臨床症状及びコンピュータ断層撮影による観察を十分に行い、出血が認められた場合には直ちに投与を中止し適切な処置を行うこと。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
脳塞栓症のおそれのある患者:心房細動、心筋梗塞、心臓弁膜疾患、感染性心内膜炎及び瞬時完成型の神経症状を呈する患者
脳塞栓症の患者は出血性脳梗塞が発現しやすいため、治療上やむを得ないと判断される場合を除き、投与しないこと。
出血している患者:消化管出血、皮下出血等
出血を助長する可能性がある。
出血の可能性のある患者:脳出血の既往歴のある患者、重症高血圧患者、重症糖尿病患者、血小板の減少している患者等
出血を助長する可能性がある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
小児等
高齢者
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
抗血小板剤 チクロピジン アスピリン等 血栓溶解剤 ウロキナーゼ アルテプラーゼ等 抗凝血剤 ヘパリン ワルファリン アルガトロバン等 | これらの薬剤と併用することにより出血傾向の増強をきたすおそれがある。
観察を十分に行い、減量するなど用量を調節すること。 | 本剤は血小板凝集能を抑制するため、類似の作用を持つ薬剤を併用することにより作用を増強する可能性がある。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
出血
〈クモ膜下出血術後の脳血管攣縮およびこれに伴う脳虚血症状の改善〉
出血性脳梗塞・硬膜外血腫・脳内出血(1.9%)、消化管出血(0.8%)、皮下出血(0.8%)、血尿(頻度不明)等があらわれることがある。本剤は血小板凝集能を抑制する。
〈脳血栓症(急性期)に伴う運動障害の改善〉
出血性脳梗塞・硬膜外血腫・脳内出血(0.3%)、消化管出血(頻度不明)、皮下出血(0.3%)、血尿(頻度不明)等があらわれることがある。血小板凝集能を抑制する。
ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、呼吸困難、喉頭浮腫、冷感等があらわれた場合には投与を中止し、適切な処置を行うこと。
肝機能障害、黄疸(いずれも頻度不明)
著しいAST・ALTの上昇等を伴う重症な肝機能障害、黄疸があらわれることがある。
血小板減少(頻度不明)
白血球減少、顆粒球減少(いずれも頻度不明)
発症時には発熱や悪寒等がみられることが多いので、これらの症状があらわれた時は本症を疑い血液検査を行うこと。
腎機能障害(頻度不明)
重篤な腎機能障害(急性腎障害等)があらわれることがある。腎機能障害時には血小板減少を伴うことが多い。
その他の副作用
| 0.1%~3%未満 | 頻度不明 |
|---|
過敏症 | 発疹、蕁麻疹、紅斑 | 喘息(様)発作、瘙痒 |
|---|
循環器 | 上室性期外収縮、血圧下降 | |
|---|
血液 | 貧血 | |
|---|
肝臓 | | AST・ALT、LDH、アルカリホスファターゼ、ビリルビンの上昇等 |
|---|
腎臓 | | BUN、クレアチニン上昇 |
|---|
消化器 | 嘔気、嘔吐、下痢、食欲不振、膨満感 | |
|---|
その他 | 発熱、頭痛、注射部の発赤・腫脹・疼痛 | CK上昇、胸内苦悶感、ほてり、悪寒・戦慄、関節炎、CRP上昇 |
|---|
適用上の注意
薬剤調製時の注意
カルシウムを含む輸液で希釈すると白濁することがあるので、カルシウムを含む輸液(リンゲル液等)を希釈に用いるときは、本剤80mgあたり300mL以上の輸液で使用すること。
薬剤投与時の注意
シリンジが破損するおそれがあるため、衝撃を避けること。
ピロー包装から取り出す際、プランジャーを持って無理に引き出さないこと。
シリンジ先端のゴム栓を外した後、シリンジ先端部に触れないこと。
薬剤投与後の注意
開封後の使用は一回限りとし、使用後の残液は容器とともに速やかに廃棄すること。
シリンジの再滅菌・再使用はしないこと。
薬効薬理
作用機序
アラキドン酸カスケード中のトロンボキサンA2(TXA2)合成酵素を選択的に阻害してTXA2の産生を抑制し、TXA2による血小板凝集能を抑制すると共に、プロスタサイクリンの産生を促進して、両者のバランス異常を改善する。また、脳血管攣縮や脳血流量低下の抑制作用も認められている。
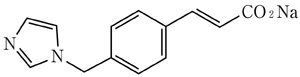
有効成分に関する理化学的知見
一般的名称
オザグレルナトリウム(Ozagrel Sodium)
化学名
Monosodium(2E)-3-[4-(1H-imidazol-1-ylmethyl)phenyl]prop-2-enoate
分子式
C13H11N2NaO2
分子量
250.23
性状
白色の結晶又は結晶性の粉末である。水に溶けやすく、メタノールにやや溶けやすく、エタノール(99.5)にほとんど溶けない。
化学構造式
取扱い上の注意
外箱開封後は遮光して保存すること。
ピロー包装は使用直前まで開封しないこと。使用に際しては、開封口からゆっくり開けること。
以下の場合には使用しないこと。
包装
〈オザグレルNa注射液20mgシリンジ「サワイ」〉
10シリンジ(1mL/シリンジ)
〈オザグレルNa注射液40mgシリンジ「サワイ」〉
10シリンジ(2mL/シリンジ)
〈オザグレルNa注射液80mgシリンジ「サワイ」〉
10シリンジ(4mL/シリンジ)
主要文献
1
第十八改正日本薬局方解説書, 廣川書店, 2021;C-1234-1238
文献請求先及び問い合わせ先
〒532-0003 大阪市淀川区宮原5丁目2-30
TEL:0120-381-999 FAX:06-7708-8966