1
Busch U et al:Eur J Clin Pharmacol. 1995; 48:269-272(L20220643)
2
東純一ほか:基礎と臨床. 1996; 30(12):3189-3210(L20220644)
3
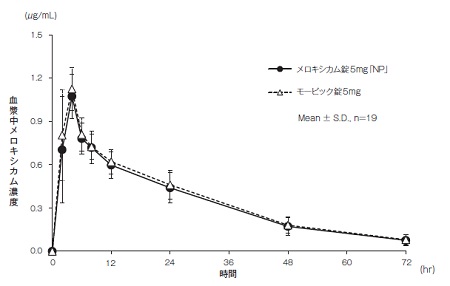
社内資料:生物学的同等性試験(錠5mg)
4
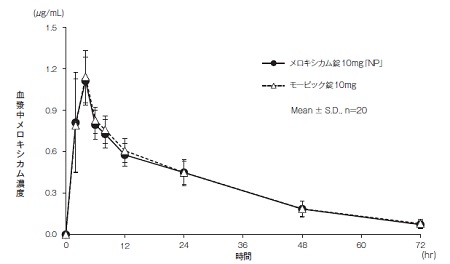
社内資料:生物学的同等性試験(錠10mg)
5
Schmid J et al:Drug Metab Dispos. 1995; 23:1206-1213(L20220645)
6
入江伸ほか:基礎と臨床. 1996; 30(12):3249-3256(L20220646)
7
大岩陽子ほか:薬物動態. 1997; 12(2):108-117(L20220647)
8
蛋白結合率のin vitro試験成績(モービックカプセル:2000年12月22日承認、申請資料概要ヘ.III-1.4)(L20230800)
9
Türck D et al:Arzneim-Forsch. 1997; 47(1):253(L20220648)
10
Chesne C et al:Xenobiotica. 1998; 28(1):1-13(L20220649)
11
Busch U:Drug Metab Dispos. 1998; 26(6):576(L20220650)
12
前期第Ⅱ相試験(慢性関節リウマチ)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(2).1))(L20230801)
13
試験別・用量別全般改善度(モービックカプセル:2000年12月22日承認、申請資料概要ト.2.(3).2))(L20230802)
14
後期第Ⅱ相試験(慢性関節リウマチ)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(3).1)~3))(L20230803)
15
水島裕ほか:基礎と臨床. 1997; 31(3):1115-1166(L20220651)
16
長期投与試験(慢性関節リウマチ)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(6))(L20230804)
17
前期第Ⅱ相試験(変形性膝関節症)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(2).2))(L20230805)
18
後期第Ⅱ相試験(変形性膝関節症)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(3).1))(L20230806)
19
青木虎吉ほか:臨床医薬. 1997; 13(4):973-1013(L20220652)
20
桜井実ほか:基礎と臨床. 1997; 31(3):1201-1283(L20220653)
21
一般臨床試験(腰痛症、肩関節周囲炎、頸肩腕症候群)(モービックカプセル:2000年12月22日承認、申請資料概要ト.1.(5))(L20230807)
22
Ogino K et al:Pharmacology. 1997; 55(1):44-53(L20220654)
23
Engelhardt G et al:Biochem Pharmacol. 1996; 51:21-28(L20220655)
24
Engelhardt G et al:Biochem Pharmacol. 1996; 51:29-38(L20220656)
25
Engelhardt G et al:Inflamm Res. 1995; 44:423-433(L20220657)
26
Engelhardt G et al:Inflamm Res. 1995; 44:548-555(L20220658)
27
吉田益美ほか:応用薬理. 1997; 53:351-366(L20220659)
28
消化管に対する作用の検討(モービックカプセル:2000年12月22日承認、申請資料概要ホ.1.【I】.[4])(L20230808)