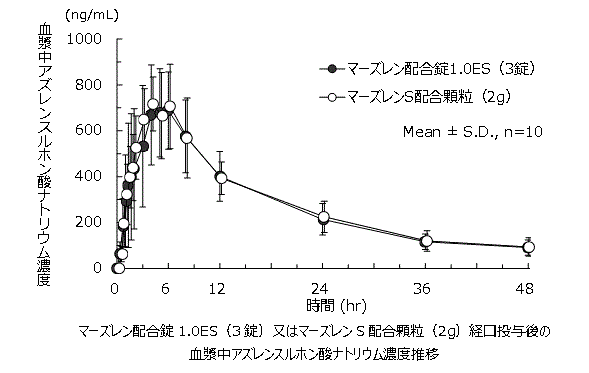
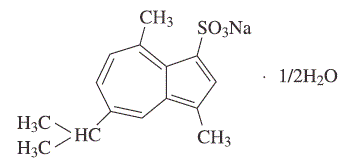
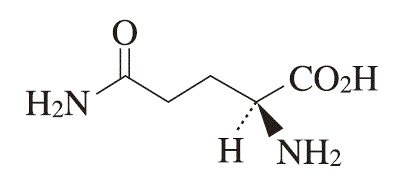
1
社内資料:マーズレン配合錠1.0ESとマーズレンS配合顆粒の製剤間のヒト生物学的同等性の検証
2
佐藤正雄ほか:薬理と治療.1998;26(4):481-484.
3
社内資料:マーズレン配合錠0.375ESと標準製剤マーズレン配合錠1.0ESとの生物学的同等性試験-溶出試験-
4
社内資料:マーズレン配合錠0.5ESと標準製剤マーズレン配合錠1.0ESとの生物学的同等性試験-溶出試験-
5
三好秋馬ほか:内科宝函.1982;29(5):297-332.
6
関口利和ほか:基礎と臨床.1977;11(2):679-686.
7
小林節雄ほか:新薬と臨牀.1981;30(11):1855-1873.
8
中沢三郎ほか:診療と新薬.1974;11(9):1839-1849.
9
内藤俊一ほか:薬理と治療.1984;12(1):183-186.
10
Martinson EE,et al.:Biokhimiia.1962;27(3):437-441.
11
Leloir LF,et al.:Biochim. Biophys. Acta.1953;12:15-22.
12
林啓一郎ほか:薬理と治療.1998;26(4):465-472.
13
川村武ほか:基礎と臨床.1985;19(13):6443-6446.
14
川村武ほか:基礎と臨床.1985;19(10):5195-5199.
15
堀裕子ほか:薬理と治療.1994;22(9):3777-3783.
16
堀裕子ほか:薬理と治療.1994;22(10):4305-4313.
17
岡部進ほか:応用薬理.1975;9(1):31-37.