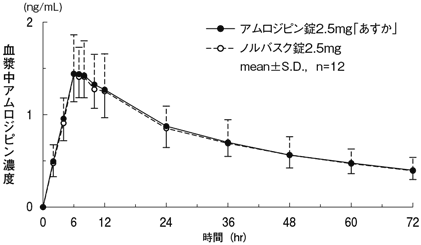
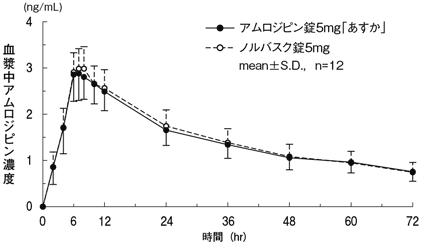
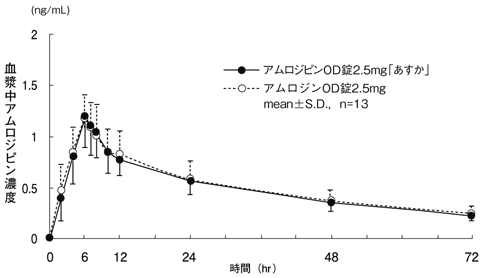
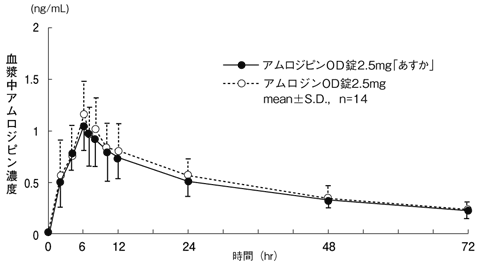
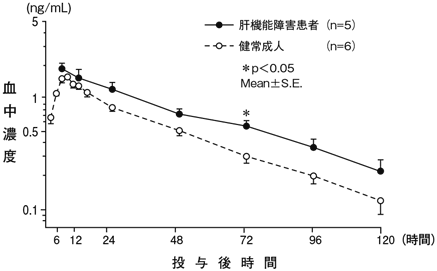
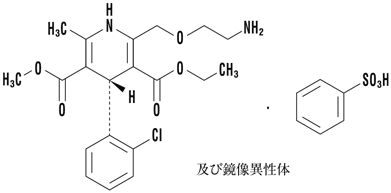
1
堀本政夫他:応用薬理.1991;42(2):167-176
2
Naito,T.et al.:J.Hum.Lact.2015;31(2):301-306
3
桑島 巌他:Geriatric Medicine.1991;29(6):899-902
4
Laine,K.et al.:Br.J.Clin.Pharmacol.1997;43(1):29-33
5
健康成人における薬物動態(ノルバスク錠・ノルバスクOD錠:2009年2月23日承認、審査報告書)
6
中島光好他:臨床医薬.1991;7(7):1407-1435
7
水山和之:医学と薬学.2008;59(5):843-856
8
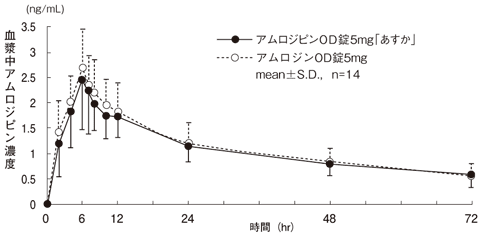
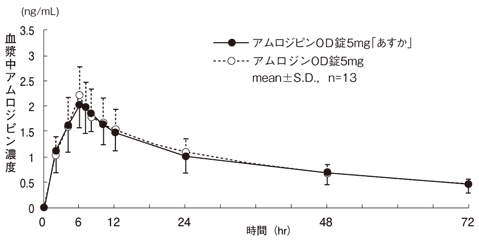
社内資料:生物学的同等性試験(アムロジピンOD錠「あすか」)
9
浦江隆次他:薬理と治療.1991;19(7):2933-2942
10
Beresford,A.P.et al.:Xenobiotica.1988;18(2):245-254
11
足立幸彦他:薬理と治療.1991;19(7):2923-2932
12
Flynn,J.T.et al.:J.Clin.Pharmacol.2006;46:905-916
13
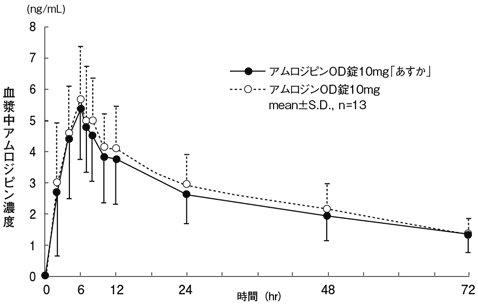
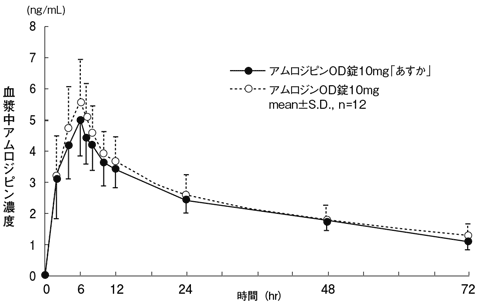
社内資料:生物学的同等性試験(アムロジピン錠10mg「あすか」)
14
増山善明他:薬理と治療.1991;19(7):2853-2871
15
増山善明他:薬理と治療.1991;19(7):2873-2893
16
増山善明他:薬理と治療.1991;19(7):2895-2908
17
増山善明他:臨床評価.1991;19(2):213-241
18
猿田享男他:薬理と治療.1993;21(2):505-526
19
山田和生他:薬理と治療.1991;19(8):3189-3203
20
Fujiwara,T.et al.:J.Hum.Hypertens.2009;23(8):521-529
21
アムロジピン5mgで効果不十分な患者に対するアムロジピン10mgの国内長期投与試験(ノルバスク錠・ノルバスクOD錠:2009年2月23日承認、審査報告書)
22
中島 譲他:薬理と治療.1991;19(8):3205-3219
23
第十七改正日本薬局方解説書.廣川書店;2016.C284-C289
24
山中教造他:日本薬理学雑誌.1991;97(3):167-178
25
山中教造他:日薬理誌.1991;97(3):115-126
26
Fleckenstein,A.et al.:Am.J.Cardiol.1989;64(17):21I-34I
27
Suzuki,M.et al.:Eur.J.Pharmacol.1993;228(5-6):269-274
28
Nayler,W.G.et al.:Am.J.Cardiol.1989;64(17):65I-70I
29
田村裕男他:薬理と治療.1990;18(Suppl.2):S339-S345