経皮吸収型 持続性疼痛治療剤
1枚 5592.9円
| 大きさ(縦×横mm) | 20.5×26.1 |
|---|---|
| 面積(cm2) | 5.25 |
| 外形 | 断面図(模式図) |
| 大きさ(縦×横mm) | 25.4×41.6 |
|---|---|
| 面積(cm2) | 10.5 |
| 外形 | 断面図(模式図) |
| 大きさ(縦×横mm) | 60.8×37.8 |
|---|---|
| 面積(cm2) | 21.0 |
| 外形 | 断面図(模式図) |
| 大きさ(縦×横mm) | 60.7×55.1 |
|---|---|
| 面積(cm2) | 31.5 |
| 外形 | 断面図(模式図) |
| 大きさ(縦×横mm) | 60.7×72.3 |
|---|---|
| 面積(cm2) | 42.0 |
| 外形 | 断面図(模式図) |
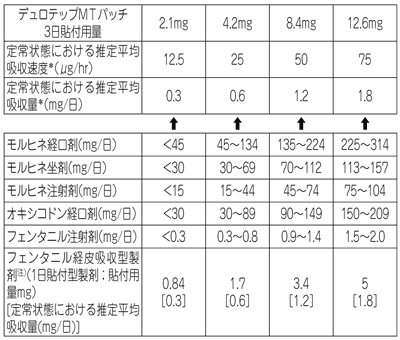
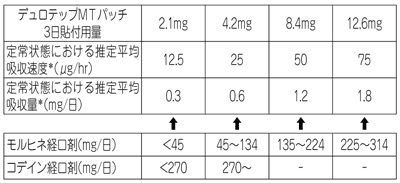
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **ナルメフェン塩酸塩(セリンクロ) | 離脱症状を起こすおそれがある。また、鎮痛作用が減弱するおそれがある。 ナルメフェン塩酸塩を投与中の患者又は投与中止後1週間以内の患者には投与しないこと。[「禁忌」の項参照] | μオピオイド受容体への競合的阻害による。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制剤(フェノチアジン系薬剤、ベンゾジアゼピン系薬剤、バルビツール酸系薬剤等)、全身麻酔剤、モノアミン酸化酵素阻害剤、三環系抗うつ剤、骨格筋弛緩剤、鎮静性抗ヒスタミン剤、アルコール、オピオイド系薬剤 | 呼吸抑制、低血圧、めまい、口渇及び顕著な鎮静又は昏睡が起こることがあるので、減量するなど慎重に投与すること。 | 相加的に中枢神経抑制作用が増強する。 |
| セロトニン作用薬(選択的セロトニン再取り込み阻害剤(SSRI)、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)、モノアミン酸化酵素阻害剤等) | セロトニン症候群(不安、焦燥、興奮、錯乱、発熱、発汗、頻脈、振戦、ミオクローヌス等)があらわれるおそれがある。 | 相加的にセロトニン作用が増強するおそれがある。 |
| *CYP3A4阻害作用を有する薬剤(リトナビル、イトラコナゾール、フルコナゾール、ボリコナゾール、アミオダロン、クラリスロマイシン、ジルチアゼム、フルボキサミン等) | 本剤のAUCの増加、血中半減期の延長が認められたとの報告がある。呼吸抑制等の副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | 肝CYP3A4に対する阻害作用により、本剤の代謝が阻害される。 |
| CYP3A4誘導作用を有する薬剤(リファンピシン、カルバマゼピン、フェノバルビタール、フェニトイン等) | 本剤の血中濃度が低下し、治療効果が減弱するおそれがある。必要に応じて本剤の用量調整を行うこと。CYP3A4誘導作用を有する薬剤の中止後、本剤の血中濃度が上昇し、重篤な呼吸抑制等の副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | 肝CYP3A4に対する誘導作用により、本剤の代謝が促進される。 |
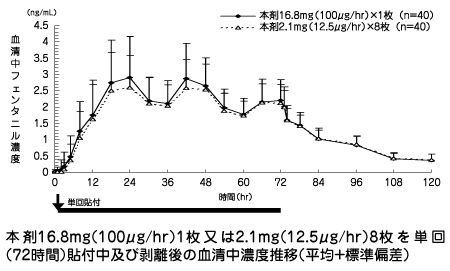
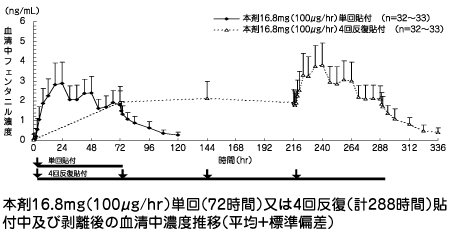
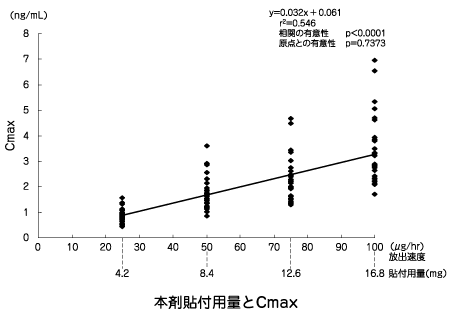
| 投与量 (貼付用量) | Tmax (hr) | Cmax (ng/mL) | t1/2 (hr) | AUC(0→120) (ng・hr/mL) | AUC (ng・hr/mL) |
| 16.8mg (100μg/hr)×1枚 (n=40) | 30.8±12.2 | 3.31±1.34 | 21.4±5.8注) | 189.5±58.7 | 202.0±61.1 |
| 2.1mg (12.5μg/hr)×8枚 (n=40) | 36.8±17.8 | 2.96±1.10 | 22.9±7.7 | 180.9±52.6 | 195.3±56.3 |
| Tmax (hr) | Cmax (ng/mL) | AUC(0→120) (ng・hr/mL) | AUC (ng・hr/mL) | t1/2 (hr) | |
| 高齢者(n=21) | 49.7±21.4 | 2.48±1.60 | 153.3±89.7 | 190.1±110 | 34.4±14.1注) |
| 成人(n=27) | 35.1±17.1 | 2.69±0.66 | 164.1±36.7 | 177.8±41.8 | 23.9±9.8 |
| Tmax (hr) | Cmax (ng/mL) | AUC(0→144) (ng・hr/mL) | t1/2 (hr) | |
| 肝硬変患者(n=9) | 40±17 | 1.52±0.70 | 123.0±71.9 | 19.8±10.2 |
| 対照群(n=8) | 33±5 | 1.13±0.51 | 71.0±28.7 | 20.6±5.7 |
| C10注1) (ng/mL) | AUC(0→10) (ng・hr/mL) | AUC(26→36) (ng・hr/mL) | AUC (ng・hr/mL) | 皮膚温(℃) 10(hr) | 皮膚温(℃) 36(hr) | |
| 非加温群 (4.2mg(25μg/hr))(n=20) | 0.379±0.27 | 1.26±1.12 | 5.06±1.84 | 32.3±13.1 | 32.7±1.42 | 32.8±0.81 |
| 加温群 (4.2mg(25μg/hr)+加温)(n=20) | 0.559±0.25 | 2.18±1.10 | 5.91±2.02 | 34.5±14.3 | 35.5±1.34 | 36.4±0.66 |
| 比注2)(加温群/非加温群、%) | 161 | 220 | 115 | 103 | − | − |
| 「非常に満足」及び「満足」 | 69.4%(59/85例) |
| 「満足・不満のどちらでもない」 | 20.0%(17/85例) |
| 「不満」及び「非常に不満」 | 10.6%(9/85例) |
| 試験 | 有効率 |
| 第I相/前期第II相臨床試験 | 61.5%(8/13例) |
| 後期第II相臨床試験(切り替え貼付試験) a群:モルヒネ投与時に疼痛管理が良好 b群:モルヒネ投与時に疼痛管理が不良 | 61.5%(99/161例) 68.9%(91/132例) 27.6%(8/29例) |
| 後期第II相臨床試験(継続貼付試験) a群:モルヒネ投与時に疼痛管理が良好 b群:モルヒネ投与時に疼痛管理が不良 | 83.3%(80/96例) 86.1%(68/79例) 70.6%(12/17例) |
| モルヒネ製剤 | オキシコドン経口剤 | フェンタニル注射剤 |
| 83.6%(1027/1228例) | 78.0%(156/200例) | 75.0%(15/20例) |
| 疼痛コントロール達成率 | 86.3%(44/51例) |
| 「VASの変化量が+15mm以下」 | 98.0%(50/51例) |
| 「レスキュー・ドーズ投与回数が1日2回以下であり、投与回数の差が1日あたり1回以下」 | 88.2%(45/51例) |
| 「非常に満足」及び「満足」 | 62.0%(31/50例) |
| 「満足・不満のどちらでもない」 | 28.0%(14/50例) |
| 「不満」及び「非常に不満」 | 10.0%(5/50例) |
| 「非常に満足」及び「満足」 | 35.2%(37/105例) |
| 「満足・不満のどちらでもない」 | 40.0%(42/105例) |
| 「不満」及び「非常に不満」 | 24.8%(26/105例) |