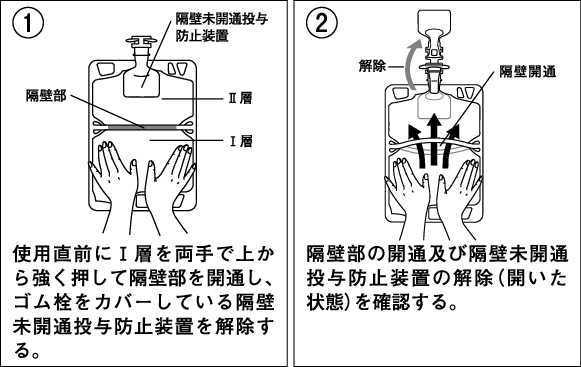
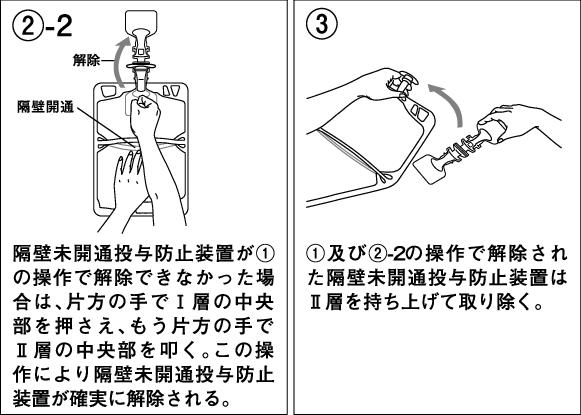
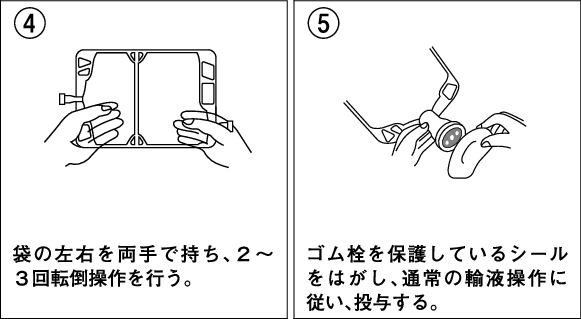
1
出月康夫, 他.:薬理と治療.1991;19(5):2039-2063
2
三條健昌, 他.:薬理と治療.1991;19(5):2065-2092
3
持田宏美, 他.:薬理と治療.1991;19(2):443-455
4
持田宏美, 他.:薬理と治療.1991;19(2):433-442
高カロリー輸液用糖・電解質・アミノ酸液
1キット 704円
有効成分 | ブドウ糖 120g |
|---|
有効成分 | 塩化ナトリウム 2.920g |
|---|---|
有効成分 | 酢酸カリウム 2.160g |
有効成分 | リン酸二水素カリウム 1.088g |
有効成分 | 硫酸マグネシウム水和物 0.7400g |
有効成分 | グルコン酸カルシウム水和物 1.792g |
有効成分 | 硫酸亜鉛水和物 5.752mg |
添加剤 | クエン酸水和物(pH調節剤) 適量 |
|---|
有効成分 | L-イソロイシン 1.120g |
|---|---|
有効成分 | L-ロイシン 2.500g |
有効成分 | L-リシン酢酸塩 2.480g L-リシンとして 1.758g |
有効成分 | L-メチオニン 0.700g |
有効成分 | L-フェニルアラニン 1.870g |
有効成分 | L-トレオニン 1.300g |
有効成分 | L-トリプトファン 0.260g |
有効成分 | L-バリン 0.900g |
有効成分 | L-アラニン 1.240g |
有効成分 | L-アルギニン 1.580g |
有効成分 | L-アスパラギン酸 0.760g |
有効成分 | L-システイン 0.200g |
有効成分 | L-グルタミン酸 1.300g |
有効成分 | L-ヒスチジン 1.200g |
有効成分 | L-プロリン 0.660g |
有効成分 | L-セリン 0.440g |
有効成分 | L-チロシン 0.070g |
有効成分 | グリシン 2.140g |
添加剤 | 亜硫酸水素ナトリウム 0.030g |
|---|
| 糖 | ブドウ糖 120g | ブドウ糖濃度 12.00% | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 電解質 | Na+注1) 50mEq | K+ 30mEq | Mg2+ 6mEq | Ca2+ 8mEq | Cl- 50mEq | SO42- 6mEq | Acetate-注2) 34mEq | Phosphate 8mmol | Gluconate- 8mEq | Zn 20μmol |
| アミノ酸 | 総遊離アミノ酸量 20.0g | 総窒素量 3.04g | 分岐鎖アミノ酸含有率 22.6w/w% | 必須アミノ酸/非必須アミノ酸 1.38 | ||||||
| 総カロリー量 | 560kcal | |||||||||
| 非蛋白カロリー量 | 480kcal | |||||||||
| 非蛋白カロリー/N | 158 |
有効成分 | ブドウ糖 180g |
|---|
有効成分 | 塩化ナトリウム 2.920g |
|---|---|
有効成分 | 酢酸カリウム 2.160g |
有効成分 | リン酸二水素カリウム 1.088g |
有効成分 | 硫酸マグネシウム水和物 0.7400g |
有効成分 | グルコン酸カルシウム水和物 1.792g |
有効成分 | 硫酸亜鉛水和物 5.752mg |
添加剤 | クエン酸水和物(pH調節剤) 適量 |
|---|
有効成分 | L-イソロイシン 1.680g |
|---|---|
有効成分 | L-ロイシン 3.750g |
有効成分 | L-リシン酢酸塩 3.720g L-リシンとして 2.637g |
有効成分 | L-メチオニン 1.050g |
有効成分 | L-フェニルアラニン 2.805g |
有効成分 | L-トレオニン 1.950g |
有効成分 | L-トリプトファン 0.390g |
有効成分 | L-バリン 1.350g |
有効成分 | L-アラニン 1.860g |
有効成分 | L-アルギニン 2.370g |
有効成分 | L-アスパラギン酸 1.140g |
有効成分 | L-システイン 0.300g |
有効成分 | L-グルタミン酸 1.950g |
有効成分 | L-ヒスチジン 1.800g |
有効成分 | L-プロリン 0.990g |
有効成分 | L-セリン 0.660g |
有効成分 | L-チロシン 0.105g |
有効成分 | グリシン 3.210g |
添加剤 | 亜硫酸水素ナトリウム 0.045g |
|---|
| 糖 | ブドウ糖 180g | ブドウ糖濃度 16.36% | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 電解質 | Na+注3) 50mEq | K+ 30mEq | Mg2+ 6mEq | Ca2+ 8mEq | Cl- 50mEq | SO42- 6mEq | Acetate-注4) 40mEq | Phosphate 8mmol | Gluconate- 8mEq | Zn 20μmol |
| アミノ酸 | 総遊離アミノ酸量 30.0g | 総窒素量 4.56g | 分岐鎖アミノ酸含有率 22.6w/w% | 必須アミノ酸/非必須アミノ酸 1.38 | ||||||
| 総カロリー量 | 840kcal | |||||||||
| 非蛋白カロリー量 | 720kcal | |||||||||
| 非蛋白カロリー/N | 158 |
有効成分 | ブドウ糖 250.4g |
|---|
有効成分 | 塩化ナトリウム 2.920g |
|---|---|
有効成分 | 酢酸カリウム 2.160g |
有効成分 | リン酸二水素カリウム 1.088g |
有効成分 | 硫酸マグネシウム水和物 0.7400g |
有効成分 | グルコン酸カルシウム水和物 1.792g |
有効成分 | 硫酸亜鉛水和物 5.752mg |
添加剤 | クエン酸水和物(pH調節剤) 適量 |
|---|
有効成分 | L-イソロイシン 2.240g |
|---|---|
有効成分 | L-ロイシン 5.000g |
有効成分 | L-リシン酢酸塩 4.960g L-リシンとして 3.516g |
有効成分 | L-メチオニン 1.400g |
有効成分 | L-フェニルアラニン 3.740g |
有効成分 | L-トレオニン 2.600g |
有効成分 | L-トリプトファン 0.520g |
有効成分 | L-バリン 1.800g |
有効成分 | L-アラニン 2.480g |
有効成分 | L-アルギニン 3.160g |
有効成分 | L-アスパラギン酸 1.520g |
有効成分 | L-システイン 0.400g |
有効成分 | L-グルタミン酸 2.600g |
有効成分 | L-ヒスチジン 2.400g |
有効成分 | L-プロリン 1.320g |
有効成分 | L-セリン 0.880g |
有効成分 | L-チロシン 0.140g |
有効成分 | グリシン 4.280g |
添加剤 | 亜硫酸水素ナトリウム 0.060g |
|---|
| 糖 | ブドウ糖 250.4g | ブドウ糖濃度 20.87% | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 電解質 | Na+注5) 51mEq | K+ 30mEq | Mg2+ 6mEq | Ca2+ 8mEq | Cl- 50mEq | SO42- 6mEq | Acetate-注6) 46mEq | Phosphate 8mmol | Gluconate- 8mEq | Zn 20μmol |
| アミノ酸 | 総遊離アミノ酸量 40.0g | 総窒素量 6.08g | 分岐鎖アミノ酸含有率 22.6w/w% | 必須アミノ酸/非必須アミノ酸 1.38 | ||||||
| 総カロリー量 | 1160kcal | |||||||||
| 非蛋白カロリー量 | 1000kcal | |||||||||
| 非蛋白カロリー/N | 164 |
| Ⅰ層 | |
| pH | 4.0~5.0 |
|---|---|
| 浸透圧比 | 約4(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| Ⅱ層 | |
| pH | 5.5~6.5 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 混合後 | |
| pH | 約5 |
|---|---|
| 浸透圧比 | 約4(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| Ⅰ層 | |
| pH | 4.0~5.0 |
|---|---|
| 浸透圧比 | 約7(生理食塩液に対する比) |
| 性状 | 無色~微黄色澄明の液 |
| Ⅱ層 | |
| pH | 5.5~6.5 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 混合後 | |
| pH | 約5 |
|---|---|
| 浸透圧比 | 約5(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| Ⅰ層 | |
| pH | 4.0~5.0 |
|---|---|
| 浸透圧比 | 約10(生理食塩液に対する比) |
| 性状 | 無色~微黄色澄明の液 |
| Ⅱ層 | |
| pH | 5.5~6.5 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 混合後 | |
| pH | 約5 |
|---|---|
| 浸透圧比 | 約7(生理食塩液に対する比) |
| 性状 | 無色澄明の液 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ジギタリス製剤 ジゴキシン等 | ジギタリス中毒(不整脈等)の症状があらわれた場合には、投与を中止すること。 | カルシウムがジギタリス製剤の作用を増強するおそれがある。 |
0.1~5%未満 | 頻度不明 | |
|---|---|---|
過敏症 | 発疹等 | |
代謝異常 | 高カリウム血症 | |
消化器 | 悪心・嘔吐 | |
肝臓 | AST、ALTの上昇 | 肝機能異常 |
大量・急速投与 | 脳浮腫、肺水腫、末梢の浮腫、水中毒 | |
その他 | 悪寒、発熱 |