添付文書番号
3259518G1059_3_05
企業コード
171575
作成又は改訂年月
日本標準商品分類番号
873259
薬効分類名
糖・電解質・アミノ酸液
承認等
販売名
ツインパル輸液
販売名コード
販売名英字表記
TWINPAL Injection
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
ツインパル輸液
販売名コード
販売名英字表記
TWINPAL Injection
承認番号等
販売開始年月
貯法、有効期間
規制区分
一般的名称
-
禁忌(次の患者には投与しないこと)
高カリウム血症、アジソン病の患者
[高カリウム血症が悪化する又は誘発されるおそれがある。]
高リン血症、副甲状腺機能低下症の患者
[高リン血症が悪化する又は誘発されるおそれがある。]
高マグネシウム血症、甲状腺機能低下症の患者
[高マグネシウム血症が悪化する又は誘発されるおそれがある。]
高カルシウム血症の患者
[高カルシウム血症が悪化するおそれがある。]
アミノ酸代謝異常症のある患者
[投与されたアミノ酸が代謝されず、アミノ酸インバランスが助長されるおそれがある。]
高度のアシドーシス(高乳酸血症)のある患者
[アシドーシスが悪化するおそれがある。]
うっ血性心不全の患者
[循環血液量の増加により、症状が悪化するおそれがある。]
閉塞性尿路疾患により尿量が減少している患者
[水分、電解質等の排泄が障害されているため、症状が悪化するおそれがある。]
重篤な腎障害のある患者又は高窒素血症の患者(いずれも透析又は血液ろ過を実施している患者を除く)
[水分、電解質の過剰投与に陥りやすく、症状が悪化するおそれがある。また、アミノ酸の代謝産物である尿素等が滞留し、症状が悪化するおそれがある。]
乏尿のある患者(透析又は血液ろ過を実施している患者を除く)
[高カリウム血症が悪化する又は誘発されるおそれがある。]
肝性昏睡又は肝性昏睡のおそれのある患者
組成・性状
組成
ツインパル輸液
Ⅰ層液
有効成分 | 塩化ナトリウム 0.399g |
|---|
有効成分 | L-乳酸ナトリウム液 2.290g L-乳酸ナトリウムとして 1.145g |
|---|
有効成分 | グルコン酸カルシウム水和物 0.560g |
|---|
有効成分 | 硫酸マグネシウム水和物 0.312g |
|---|
有効成分 | 硫酸亜鉛水和物 0.700mg |
|---|
添加剤 | 亜硫酸水素ナトリウム 0.01505g 氷酢酸(pH調節剤) 適量 |
|---|
Ⅱ層液
有効成分 | L-ロイシン 2.100g |
|---|
有効成分 | L-イソロイシン 1.200g |
|---|
有効成分 | L-バリン 1.200g |
|---|
有効成分 | L-リシン塩酸塩 1.965g L-リシンとして 1.573g |
|---|
有効成分 | L-トレオニン 0.855g |
|---|
有効成分 | L-トリプトファン 0.300g |
|---|
有効成分 | L-メチオニン 0.585g |
|---|
有効成分 | L-フェニルアラニン 1.050g |
|---|
有効成分 | L-システイン 0.150g |
|---|
有効成分 | L-チロシン 0.075g |
|---|
有効成分 | L-アルギニン 1.575g |
|---|
有効成分 | L-ヒスチジン 0.750g |
|---|
有効成分 | L-アラニン 1.200g |
|---|
有効成分 | L-プロリン 0.750g |
|---|
有効成分 | L-セリン 0.450g |
|---|
有効成分 | グリシン 0.885g |
|---|
有効成分 | L-アスパラギン酸 0.150g |
|---|
有効成分 | L-グルタミン酸 0.150g |
|---|
添加剤 | 亜硫酸水素ナトリウム 0.030g 氷酢酸(pH調節剤) 適量 |
|---|
混合後(1袋中)
| 糖 | ブドウ糖 37.50g | ブドウ糖濃度 7.5% |
|---|
| 電解質 | Na+注1) 17.5mEq | K+ 10mEq | Mg2+ 2.5mEq | Ca2+ 2.5mEq | Cl- 17.5mEq | SO42- 2.5mEq | Gluconate- 2.5mEq | Lactate- 10mEq | P 5mmol | Zn 2.5μmol |
|---|
| アミノ酸 | 総遊離アミノ酸量 15.00g | 総窒素量 2.36g | 分岐鎖アミノ酸含有率 30w/w% | 必須アミノ酸/非必須アミノ酸 1.79 |
|---|
| 総カロリー量 | 210kcal |
|---|
| 非蛋白カロリー量 | 150kcal |
|---|
| 非蛋白カロリー/N | 64 |
|---|
ツインパル輸液
Ⅰ層液
有効成分 | 塩化ナトリウム 0.798g |
|---|
有効成分 | L-乳酸ナトリウム液 4.578g L-乳酸ナトリウムとして 2.289g |
|---|
有効成分 | グルコン酸カルシウム水和物 1.120g |
|---|
有効成分 | 硫酸マグネシウム水和物 0.623g |
|---|
有効成分 | 硫酸亜鉛水和物 1.400mg |
|---|
添加剤 | 亜硫酸水素ナトリウム 0.0301g 氷酢酸(pH調節剤) 適量 |
|---|
Ⅱ層液
有効成分 | L-ロイシン 4.200g |
|---|
有効成分 | L-イソロイシン 2.400g |
|---|
有効成分 | L-バリン 2.400g |
|---|
有効成分 | L-リシン塩酸塩 3.930g L-リシンとして 3.146g |
|---|
有効成分 | L-トレオニン 1.710g |
|---|
有効成分 | L-トリプトファン 0.600g |
|---|
有効成分 | L-メチオニン 1.170g |
|---|
有効成分 | L-フェニルアラニン 2.100g |
|---|
有効成分 | L-システイン 0.300g |
|---|
有効成分 | L-チロシン 0.150g |
|---|
有効成分 | L-アルギニン 3.150g |
|---|
有効成分 | L-ヒスチジン 1.500g |
|---|
有効成分 | L-アラニン 2.400g |
|---|
有効成分 | L-プロリン 1.500g |
|---|
有効成分 | L-セリン 0.900g |
|---|
有効成分 | グリシン 1.770g |
|---|
有効成分 | L-アスパラギン酸 0.300g |
|---|
有効成分 | L-グルタミン酸 0.300g |
|---|
添加剤 | 亜硫酸水素ナトリウム 0.060g 氷酢酸(pH調節剤) 適量 |
|---|
混合後(1袋中)
| 糖 | ブドウ糖 75.00g | ブドウ糖濃度 7.5% |
|---|
| 電解質 | Na+注2) 35mEq | K+ 20mEq | Mg2+ 5mEq | Ca2+ 5mEq | Cl- 35mEq | SO42- 5mEq | Gluconate- 5mEq | Lactate- 20mEq | P 10mmol | Zn 5μmol |
|---|
| アミノ酸 | 総遊離アミノ酸量 30.00g | 総窒素量 4.71g | 分岐鎖アミノ酸含有率 30w/w% | 必須アミノ酸/非必須アミノ酸 1.79 |
|---|
| 総カロリー量 | 420kcal |
|---|
| 非蛋白カロリー量 | 300kcal |
|---|
| 非蛋白カロリー/N | 64 |
|---|
製剤の性状
ツインパル輸液
| Ⅰ層液 |
|
| pH | 4.5~5.5 |
|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
| Ⅱ層液 |
|
| pH | 6.5~7.5 |
|---|
| 浸透圧比 | 約4(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
| 混合後 |
|
| pH | 約6.9 |
|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
ツインパル輸液
| Ⅰ層液 |
|
| pH | 4.5~5.5 |
|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
| Ⅱ層液 |
|
| pH | 6.5~7.5 |
|---|
| 浸透圧比 | 約4(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
| 混合後 |
|
| pH | 約6.9 |
|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
|---|
| 性状 | 無色澄明の液 |
|---|
効能又は効果
用法及び用量
用時に隔壁を開通してⅠ層液とⅡ層液をよく混合する。
通常、成人には1回500mLを末梢静脈内に点滴静注する。
投与速度は、通常、成人500mL当たり120分を基準とし、老人、重篤な患者には更に緩徐に注入する。
なお、年齢、症状、体重により適宜増減するが、最大投与量は1日2500mLまでとする。
用法及び用量に関連する注意
経口摂取不十分で、本剤にて補助的栄養補給を行う場合には、栄養必要量及び経口摂取量などを総合的に判断して、本剤の投与を行うこと。
本剤のみでは1日必要量のカロリー補給は行えないので、本剤の使用は短期間にとどめること。
手術後における本剤の単独投与はできるだけ短期間(3~5日間)とし、速やかに経口・経腸管栄養ないし他の栄養法に移行すること。
重要な基本的注意
透析又は血液ろ過を実施している重篤な腎障害、高窒素血症又は乏尿のある患者における、水分、電解質、尿素等の除去量、蓄積量は透析の方法及び病態によって異なる。血液生化学検査、酸塩基平衡、体液バランス等の評価により患者の状態を確認した上で投与開始及び継続の可否を判断すること。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
アシドーシスのある患者
アシドーシスが悪化するおそれがある。
糖尿病の患者
血糖値が上昇することにより、症状が悪化するおそれがある。
心臓、循環器系に機能障害のある患者
循環血液量の増加により、症状が悪化するおそれがある。
腎機能障害患者
重篤な腎障害、高窒素血症又は乏尿のある患者(いずれも透析又は血液ろ過を実施している患者を除く)
投与しないこと。
透析又は血液ろ過を実施している重篤な腎障害、高窒素血症又は乏尿のある患者
水分、電解質の過剰投与や、アミノ酸の代謝産物である尿素等の滞留がおこるおそれがある。
腎障害のある患者(重篤な腎障害、高窒素血症又は乏尿のある患者を除く)
水分、電解質の過剰投与に陥りやすく、症状が悪化するおそれがある。
肝機能障害患者
肝性昏睡又は肝性昏睡のおそれのある患者
投与しないこと。アミノ酸の代謝が十分に行われないため、症状が悪化する又は誘発されるおそれがある。
肝障害のある患者(肝性昏睡又は肝性昏睡のおそれのある患者を除く)
水分、電解質代謝異常が悪化する又は誘発されるおそれがある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
高齢者
投与速度を緩徐にし、減量するなど注意すること。一般に生理機能が低下している。
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
その他の副作用
| 頻度不明 |
|---|
過敏症 | 発疹等 |
|---|
消化器 | 悪心・嘔吐 |
|---|
循環器 | 胸部不快感、動悸 |
|---|
肝臓 | AST、ALT、Al-P、総ビリルビンの上昇 |
|---|
大量・急速投与 | アシドーシス、脳浮腫、肺水腫、末梢の浮腫、高カリウム血症、水中毒 |
|---|
その他 | 血管痛、静脈炎、悪寒、発熱、熱感、頭痛 |
|---|
適用上の注意
全般的な注意
使用時には、感染に対する配慮をすること。
注射針や輸液セットのびん針は、ゴム栓の刻印部(凹部)に垂直にゆっくりと刺すこと。斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれがある。また、針は同一箇所に繰り返し刺さないこと。
薬剤調製時の注意
調製手順
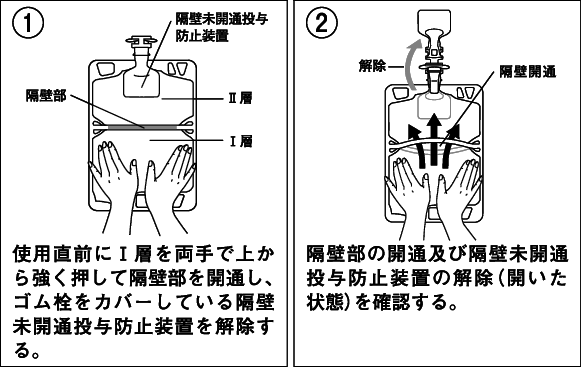
用時に外袋を開封し、容器を取り出す。
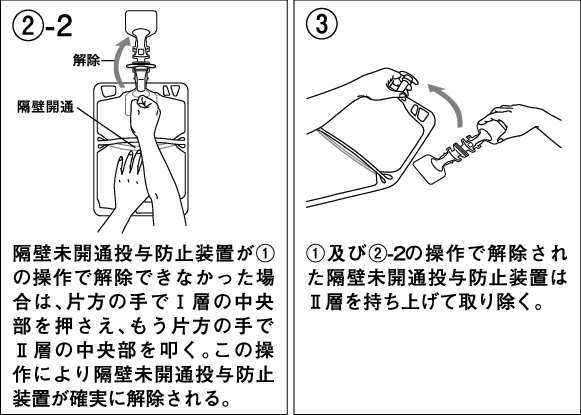
Ⅰ層を両手で強く押し、Ⅰ層とⅡ層の間の隔壁を開通させる。
開通操作後は隔壁が開通していることを確認する。
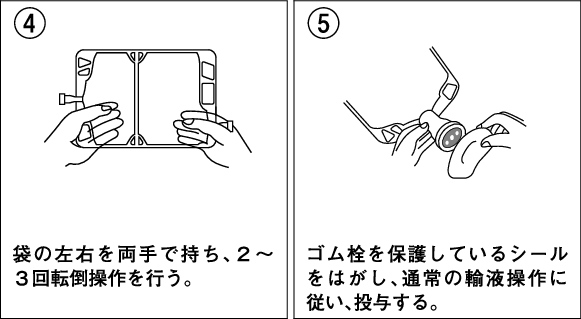
両手で容器を持ち、転倒操作により十分に混合する。
薬剤を配合する場合には、配合変化に注意すること。
薬剤投与時の注意
血管痛があらわれた場合には、注射部位を変更すること。また、場合によっては投与を中止すること。
血管外漏出が原因と考えられる皮膚壊死、潰瘍形成が報告されているので、点滴部位の観察を十分に行い、発赤、浸潤、腫脹などの血管外漏出の徴候があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。
原則として、連結管を用いたタンデム方式による投与は行わないこと。輸液セット内に空気が流入するおそれがある。
容器の目盛りは目安として使用すること。
残液は使用しないこと。
薬効薬理
作用機序
本剤はアミノ酸、電解質及び水分の補給効果を示す。
取扱い上の注意
液漏れの原因となるので、強い衝撃や鋭利なものとの接触等を避けること。
品質保持のためにガスバリア性の外袋で包装し、脱酸素剤を封入しているので、外袋は使用時まで開封しないこと。
以下の場合には使用しないこと。
外袋が破損している場合
外袋内や容器表面に水滴や結晶が認められる場合
容器から薬液が漏れている場合
容器を振とうしても溶解しない結晶が認められる場合
性状その他薬液に異状が認められる場合
ゴム栓部のシールがはがれている場合
隔壁を開通する前に、既に隔壁が開通している場合
包装
500mL×20袋(プラスチックバッグ)[脱酸素剤入り]
1000mL×10袋(プラスチックバッグ)[脱酸素剤入り]
文献請求先及び問い合わせ先
製造販売業者等
エイワイファーマ株式会社
東京都中央区日本橋浜町二丁目31番1号
株式会社陽進堂
富山県富山市婦中町萩島3697番地8号
[混合方法]
容器を外袋から取り出したのち、以下の図のように取り扱う。