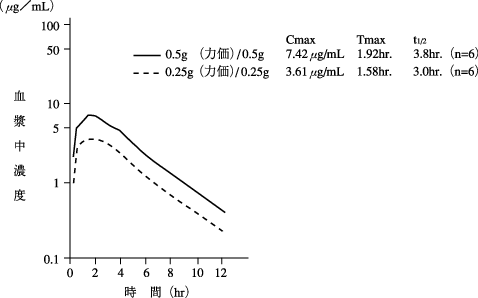
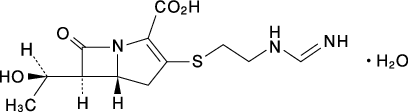
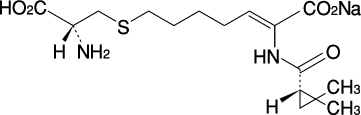
1
厚生労働省健康局結核感染症課編. 抗微生物薬適正使用の手引き
2
臼居敏仁、他. Chemotherapy. 1985;33:217-26.
3
大西明弘、他. Jpn J Antibiot. 1991;44:860-76.
4
鈴山洋司、他. Chemotherapy. 1985;33:694-711.
5
伊藤康久、他. Chemotherapy. 1985;33:825-33.
6
谷村 弘、他. Chemotherapy. 1985;33:982-1000.
7
岩井重富、他. Chemotherapy. 1985;33:950-62.
8
鈴木啓一郎、他. Chemotherapy. 1985;33:942-9.
9
松田静治、他. Jpn J Antibiot. 1986;39:1626-55.
10
小島忠士、他. Jpn J Antibiot. 1986;39:1938-46.
11
松田静治、他. Jpn J Antibiot. 1988;41:1731-41.
12
布施愛索、他. Chemotherapy. 1985;33:1-13.
13
朝日良成、他. Chemotherapy. 1985;33:54-73.
14
Kahan FM, et al. J Antimicrob Chemother. 1983;12:1-35.
15
Birnbaum J, et al. Am J Med. 1985;78:3-21.