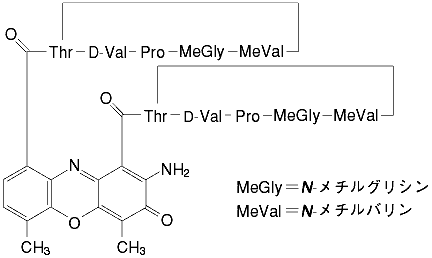
1
Tattersall MHN, et al. Clin Pharmacol Ther. 1975; 17(6): 701-8
2
高見沢裕吉, 他: 産婦人科の世界. 1967; 19(6): 597-604
3
Sobell HM, et al. J Mol Biol. 1972; 68(1): 21-34
4
Sugiura K, et al. Ann N Y Acad Sci. 1956; 63(5): 962-76
5
Sugiura K, Ann N Y Acad Sci. 1960; 89: 368-72
6
DiPaolo JA, et al. Cancer Res. 1957; 17(11): 1127-34
7
DiPaolo JA, Ann N Y Acad Sci. 1960; 89: 408-20
8
松本慶蔵, J Antibiotics Ser B. 1961; 14(1): 1-14