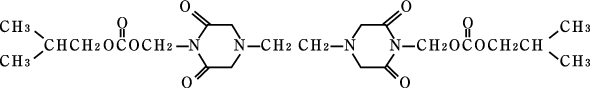1
清水 康資ら:医薬品研究. 1991;22:483-495
2
古江 尚ら:癌と化学療法. 1990;17:1287-1294
3
「MST-16の血清タンパク結合に関する実験」(社内資料)
4
平野 豊ら:医薬品研究. 1991;22:861-873
5
「MST-16の代謝部位の検討-門脈血中濃度と組織エステラーゼ活性の測定-」(社内資料)
6
「ヒトにおけるMST-16経口投与後の尿中排泄」(社内資料)
7
冨永 信彦ら:癌と化学療法. 1991;18:2441-2446
8
正岡 徹ら:癌と化学療法. 1992;19:339-347
9
「MST-16(Sobuzoxane)の悪性リンパ腫に対する後期臨床第Ⅱ相試験」(社内資料)
10
山田 一正ら:癌と化学療法. 1991;18:2447-2452
11
Ohno R, et al.:Cancer. 1993;71:2217-2221
12
「MST-16の非ホジキンリンパ腫に対する臨床第Ⅲ相パイロット試験 総括報告書」(社内資料)
13
Tanabe K, et al.:Cancer Res. 1991;51:4903-4908
14
Ishida R, et al.:Cancer Res. 1991;51:4909-4916
15
Narita T, et al.:Cancer Chemother. Pharmacol. 1990;26:193-197
16
Narita T, et al.:Cancer Chemother. Pharmacol. 1991;28:235-240