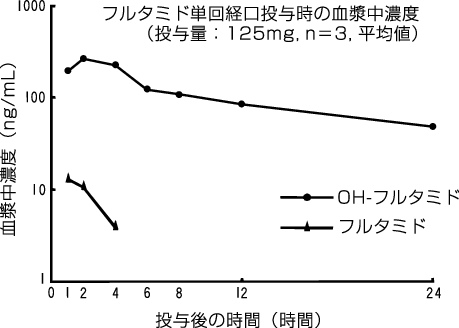
1
社内資料:単回投与試験
2
社内資料:反復投与試験
3
社内資料:血漿たん白結合
4
社内資料:尿中代謝物の検索と排泄
5
阿曽佳郎ほか 泌尿紀要 1993;39:391-403
6
Akaza H, et al.:Jpn J Clin Oncol. 1993;23:178-185
7
黒岩俊介ほか 基礎と臨床 1995;29:877-885
8
黒岩俊介ほか 基礎と臨床 1995;29:887-897
前立腺癌治療剤
1錠 152.5円
有効成分 | 1錠中フルタミド 125mg |
|---|---|
添加剤 | 無水乳糖、トウモロコシデンプン、部分アルファー化デンプン、セルロース、ラウリル硫酸ナトリウム、ステアリン酸マグネシウム |
| 剤形 | 素錠 |
|---|---|
| 色調 | 淡黄色 |
| 外形 | 表面  側面  |
| 大きさ | 大きさ(直径) 8.5mm 大きさ(厚さ) 約4.0mm |
| 質量 | 0.235g |
| 識別コード | NK7205 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ワルファリン | ワルファリンの抗凝固作用を増強するとの報告がある。 | 機序不明 |
10%以上 | 1~10%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|---|
肝臓 | AST上昇、ALT上昇 | γ-GTP上昇、Al-P上昇 | LDH上昇 | ビリルビン上昇 |
内分泌系 | 女性型乳房(22.2%) | ポテンツ低下 | ||
消化器 | 悪心・嘔吐、下痢 | 食欲不振 | 胸やけ、胃痛、胃部不快感、口渇 | |
血液 | 白血球減少 | 貧血、血小板減少 | ||
腎臓 | BUN上昇、尿蛋白陽性 | クレアチニン上昇 | ||
精神神経系 | めまい | ふらつき、立ちくらみ、頭痛、脱力感、傾眠、不眠、混乱、うつ状態、不安感、神経過敏症 | ||
過敏症 | 発疹、光線過敏症 | |||
皮膚 | そう痒 | |||
その他 | 尿糖陽性、血清総蛋白減少 | 浮腫、全身倦怠感、発熱、潮紅、発汗、味覚障害、血糖値上昇 |
薬剤投与群 評価項目 | 本剤とLH-RHアゴニストとの併用投与群 | LH-RHアゴニスト単独投与群 | 検定結果 |
全生存期間 中央値 95%信頼区間 | (107例) 1841日 1594日~ | (53例) 1530日 1124日~ | Log-Rank P=0.2053 G.Wilcoxon P=0.0869 |
非再燃期間 中央値 95%信頼区間 | (107例) 572日 401日~1094日 | (53例) 334日 243日~417日 | Log-Rank P=0.0021 G.Wilcoxon P=0.0013 |
抗腫瘍効果(総合判定) 奏効率 95%信頼区間 | 70.1%(75/107例) 60.5%~78.6% | 49.1%(26/53例) 35.1%~63.2% | χ2検定 P=0.0094 |
安全性(副作用発現症例率) 自覚症状・他覚所見 臨床検査値異常 | 42.2%(46/109例) 60.6%(66/109例) | 30.2%(16/53例) 52.8%(28/53例) | χ2検定 P=0.1400 P=0.3502 |