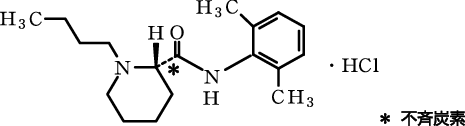
1
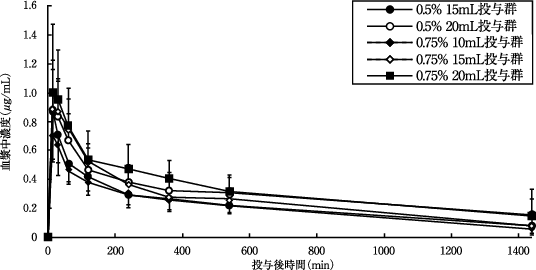
硬膜外投与時の薬物動態(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.2.2 2)(2)①)
2
硬膜外麻酔における第Ⅱ相臨床試験(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.6 14))
3
薬物動態試験-健康成人男子における単回静脈内投与-(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.6 8))
4
薬物動態試験-高齢者における単回静脈内投与-(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.6 9))
5
血漿蛋白結合(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.4.4 2))
6
チトクロムP450による代謝(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.4.5 3))
7
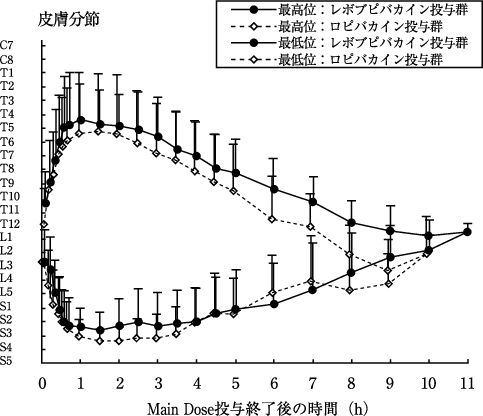
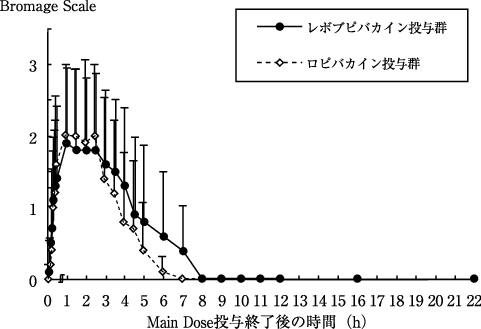
硬膜外麻酔における第Ⅲ相臨床試験(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.6 15))
8
弓削 孟文 他:麻酔と蘇生, 2008;44(Suppl.):135-149[E2080066]
9
硬膜外投与による麻酔効果(アドレナリンとの併用)(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.7.6 26))
10
ラットへの硬膜外投与における知覚および運動神経遮断作用の塩酸ブピバカインとの比較(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.2.2 2)添付資料4.2.1.1-2)
11
ラットへの硬膜外投与における知覚および運動神経遮断作用の塩酸ロピバカインとの比較(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.2.2 2)添付資料4.2.1.1-3)
12
イヌにおける痙攣誘発用量の類薬(塩酸ブピバカイン、塩酸ロピバカイン)との比較(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.6.8 6)添付資料4.2.3.7.7-5)
13
イヌにおける痙攣誘発に対する蘇生処置の影響の類薬(塩酸ブピバカイン、塩酸ロピバカイン)との比較(ポプスカイン0.75%注75mg/10mL他:2008年4月16日承認、申請資料概要2.6.6.8 6)添付資料4.2.3.7.7-6)