1
社内資料:胚・胎児発生に関する試験(承認年月日:2008.4.16、CTD2.6.6.6)[L20080218001]
2
社内資料:排泄の検討(ラット)(承認年月日:2008.4.16、CTD2.6.4.6)[L20080218002]
3
NDBを用いた調査結果の概要(VEGF/VEGFR阻害作用を有する薬剤の動脈解離に関するリスク評価):https://www.pmda.go.jp/files/000266521.pdf
4
社内資料:反復投与毒性試験(承認年月日:2008.4.16、CTD2.6.6.3)[L20080218003]
5
社内資料:6ヵ月がん原性試験(マウス)(承認年月日:2012.8.10、CTD2.6.6.5)[L20100521002]
6
社内資料:2年間がん原性試験(ラット)(承認年月日:2012.8.10、CTD2.6.6.5)[L20110614040]
7
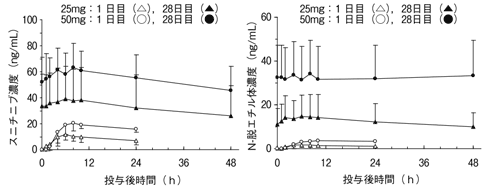
社内資料:健康成人における薬物動態(単回投与)(承認年月日:2008.4.16、CTD2.7.2.2.2.1)[L20080218004]
8
社内資料:国内第Ⅰ/Ⅱ相試験(消化管間質腫瘍) (承認年月日:2008.4.16、CTD2.7.2.2.2.4、2.7.6)[L20080218005]
9
社内資料:国内第Ⅱ相試験(膵神経内分泌腫瘍)(承認年月日:2012.8.10、CTD2.7.2.2.1、2.7.6)[L20120217025]
10
社内資料:健康成人における薬物動態(食事の影響)(承認年月日:2008.4.16、CTD2.7.3A、2.7.1.2)[L20080218006]
11
社内資料:代謝物の検討(承認年月日:2008.4.16、CTD2.6.4.5)[L20080218007]
12
社内資料:健康成人における薬物動態(承認年月日:2008.4.16、CTD2.7.2.2.2.1.2)[L20080218009]
13
Khosravan, R. et al.:J Clin Pharmacol. 2010;50(4):472-481[L20090930096]
14
社内資料:肝機能障害者における薬物動態(承認年月日:2008.4.16、CTD2.7.2.2.2.6)[L20080218011]
15
社内資料:ケトコナゾールとの薬物相互作用 (承認年月日:2008.4.16、CTD2.7.2.2.2.7)[L20080218010]
16
社内資料:外国第Ⅰ/Ⅱ相試験(消化管間質腫瘍)(承認年月日:2008.4.16、CTD2.7.3A.2、2.7.6)[L20080218015]
17
社内資料:外国第Ⅲ相試験(消化管間質腫瘍)(承認年月日:2008.4.16、CTD2.7.6)[L20080218016]
18
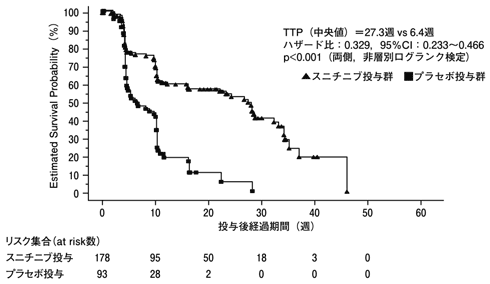
社内資料:国内第Ⅱ相試験(腎細胞癌)(承認年月日:2008.4.16、CTD2.7.6)[L20080218014]
19
社内資料:外国第Ⅱ相試験(腎細胞癌)(承認年月日:2008.4.16、CTD2.7.6)[L20080218018]
20
社内資料:外国第Ⅱ相試験(腎細胞癌)(承認年月日:2008.4.16、CTD2.7.6)[L20080218017]
21
社内資料:外国第Ⅲ相試験(腎細胞癌)(承認年月日:2008.4.16、CTD2.7.6)[L20080218019]
22
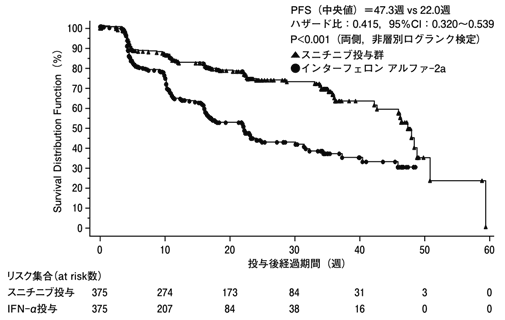
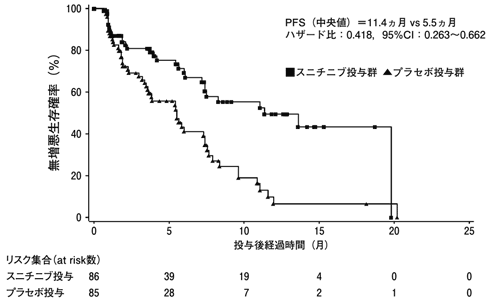
Raymond, E. et al.:New Engl J Med. 2011;364(6):501-513[L20110221093]
23
社内資料:固形がん患者におけるQT間隔に対する影響 (承認年月日:2008.4.16、CTD2.7.4.4.2.2.4)[L20080218013]
24
社内資料:薬効薬理試験(承認年月日:2008.4.16、CTD2.6.2.2)[L20080218020]