1
社内資料:日本人健康成人男子における単回皮下投与試験(2008年1月25日承認、CTD2.7.2.3)
2
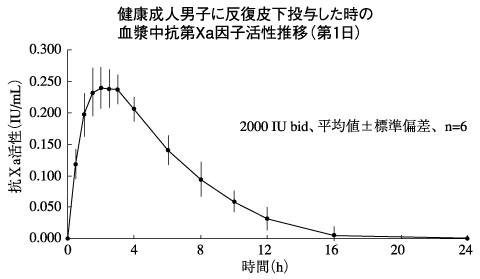
社内資料:日本人健康成人男子における反復皮下投与試験(2008年1月25日承認、CTD2.7.2.3)
3
Laforest M D, et al.:Br J Haematol. 1991;77(2):201-8
4
社内資料:腎機能障害患者における薬物動態(2008年1月25日承認、CTD2.7.2.3)
5
社内資料:股関節全置換術患者における有効性及び安全性1(2008年1月25日承認、CTD2.7.6.2)
6
社内資料:下肢整形外科手術における比較的よくみられる有害事象(2008年1月25日承認、CTD2.7.4.2)
7
社内資料:膝関節全置換術患者における有効性及び安全性(2008年1月25日承認、CTD2.7.6.2)
8
社内資料:股関節全置換術患者における有効性及び安全性2(2008年1月25日承認、CTD2.7.6.2)
9
社内資料:股関節骨折術患者における安全性及び有効性(2008年1月25日承認、CTD2.7.6.2)
10
社内資料:腹部外科手術患者における有効性及び安全性
11
社内資料:腹部外科手術における比較的よくみられる有害事象
12
社内資料:抗凝固作用の作用機序(2008年1月25日承認、CTD2.6.2.2)
13
社内資料:各種血栓モデルにおける抗血栓作用(2008年1月25日承認、CTD2.6.2.2)
14
社内資料:血小板凝集能への影響(2008年1月25日承認、CTD2.6.2.3)