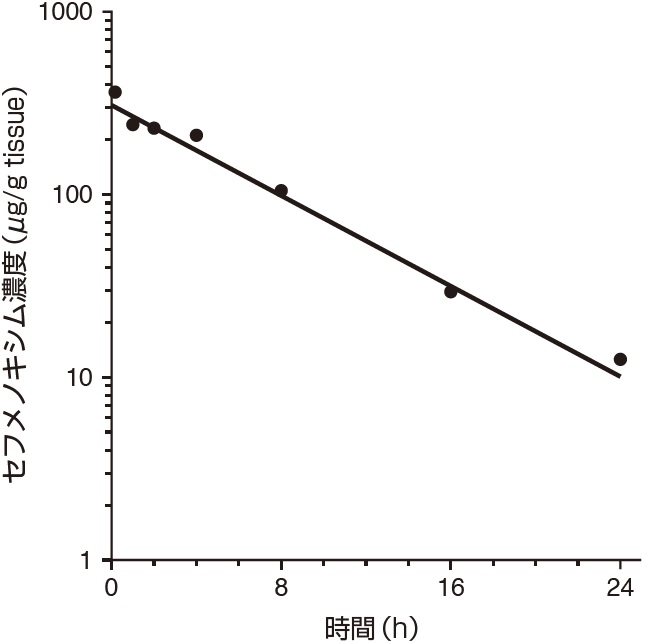
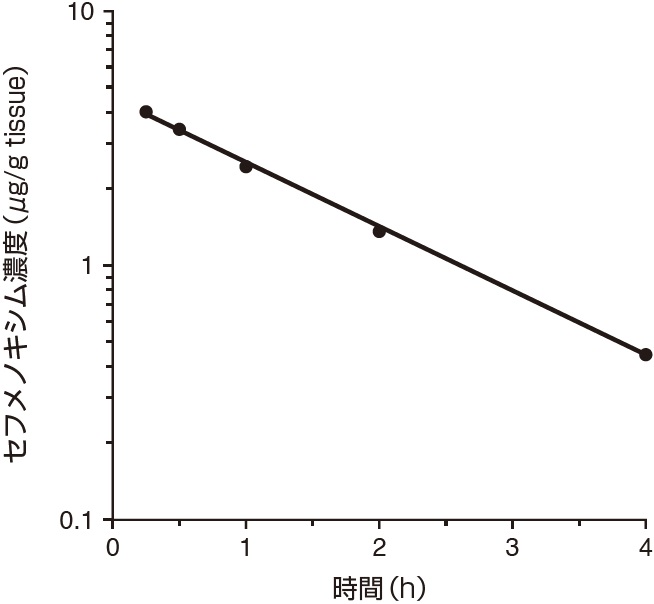
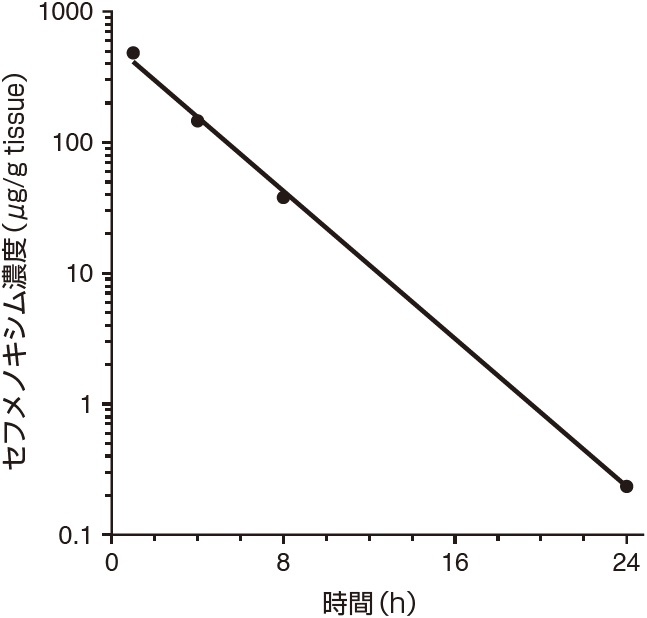
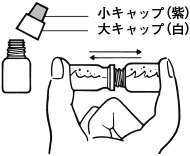
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
杉田麟也 他:耳鼻咽喉科臨床,1983;76:3007-3014
3
馬場駿吉 他:耳鼻咽喉科臨床,1996;89:1521-1524
4
馬場駿吉 他:耳鼻と臨床,1985;31:525-568
5
廖原東紅 他:耳鼻咽喉科臨床,1984;77:2003-2011
6
坂本 裕 他:新薬と臨床,1985;34:1299-1301
7
杉田麟也 他:耳鼻と臨床,1984;30:1152-1165
8
大西信治郎 他:耳鼻と臨床,1984;30:855-863
9
高須賀信夫 他:耳鼻咽喉科展望,1985;28(S-1):45-58
10
林 度生 他:耳鼻咽喉科展望,1985;28(S-1):32-44
11
馬場駿吉 他:耳鼻と臨床,1991;37:851-880
12
馬場駿吉 他:耳鼻と臨床,1991;37:833-850
13
土屋皖司 他:Chemotherapy,1981;29(S-1):96-158
14
西野武志 他:Chemotherapy,1981;29(S-1):57-88
15
小林とよ子 他:Chemotherapy,1981;29(S-1):42-52
16
馬場駿吉 他:日本耳鼻咽喉科感染症研究会会誌,1989;7:184-198
17
馬場駿吉 他:耳鼻と臨床,1995;41:192-217
18
木下治二 他:耳鼻咽喉科臨床,1984;77:1395-1400
19
佐藤喜一 他:耳鼻と臨床,1984;30:51-56
20
橋本真実 他:耳鼻咽喉科臨床,1984;77:471-482
21
山本佑二郎 他:薬理と治療,1986;14:1341-1347
22
奴久妻聡一 他:薬理と治療,1991;19:1401-1410
23
松根彰志 他:耳鼻咽喉科臨床,1990;83:119-128