1
Bursztyn, M. et al.:Arch. Intern. Med. 1986;146:397
2
Elkayam, U. et al.:Circulation. 1990;82:1954-1961
3
Kleinbloesem, C.H. et al.:Clin. Pharmacol. Ther. 1986;40:21-28
4
Zenarola, P. et al.:Dermatologica. 1991;182:196-198
5
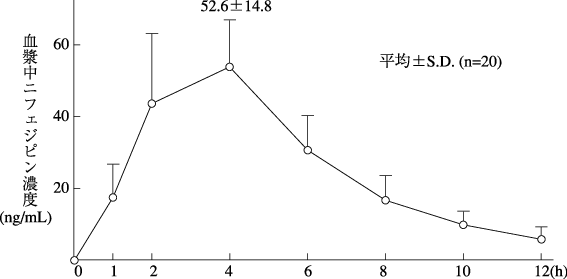
社内資料:ニフェジピンの血漿中濃度
6
Muller-Enoch, D.:Arzneim.-Forsch./Drug Res. 1999;49:470-475
7
社内資料:ニフェジピンの尿中代謝物
8
梶原長雄 他:医学と薬学 1988;20:1143-1157
9
額田忠篤 他:基礎と臨床 1988;22:4959-4970
10
額田忠篤 他:医学と薬学 1990;24:1335-1353
11
梶原長雄 他:医学と薬学 1988;20:1133-1142
12
北畠顕 他:基礎と臨床 1988;22:4943-4958
13
Ishii, H. et al.:Eur. J. Pharmacol. 1980;64:21-29
14
Morita, T. et al.:Arzneim.-Forsch./Drug Res. 1982;32:1047-1052
15
Kubo, T. et al.:J. Pharmacobio-Dyn. 1981;4:294-300
16
森田富範 他:基礎と臨床 1979;13:2879-2882
17
森田富範 他:基礎と臨床 1978;12:3041-3046
18
Morita, T. et al.:Arzneim.-Forsch./Drug Res. 1982;32:1053-1056