1
加藤和三 他:基礎と臨床. 1993;27(13):5261-5274
2
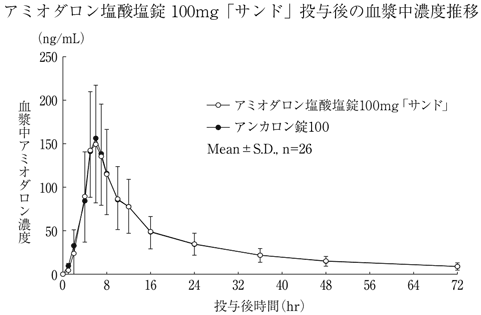
社内資料:生物学的同等性試験(アミオダロン塩酸塩錠100mg「サンド」)
3
第十八改正日本薬局方解説書, 廣川書店, 2021;C-256-263
4
加藤和三 他:臨床医薬. 1990;6(11):2311-2338
5
戸嶋裕徳 他:臨床医薬. 1991;7(1):129-149
6
Harris, L. et al.:AMIODARONE, Médecine et SciencesInternationales, 1986;1-44
7
Charlier, R., et al.:J. Pharmacol. 1970;1(2):175-182
8
Singh, B. N., et al.:Br. J. Pharmacol. 1970;39:657-667
9
Pallandi, R. T., et al.:Br. J. Pharmacol. 1987;92:97-103
10
Kato, R., et al.:Am. Heart J. 1988;115(2):351-359