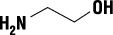1
中島新一郎他:病院薬学.1989;15(3):229-234
2
松原行雄他:薬理と治療.1989;17(2):475-494
3
高瀬靖広他:基礎と臨床.1989;23(8):3175-3191
4
熊谷義也他:基礎と臨床.1989;23(8):3208-3229
5
社内資料:医師主導臨床試験:胃静脈瘤
6
Masaki,M.et al.:Gastroent.Jpn.1990;25(2):230-235
7
折笠和栄:日本消化器病学会雑誌.1989;86(10):2365-2372
食道静脈瘤硬化療法・胃静脈瘤退縮剤
1瓶 16092円
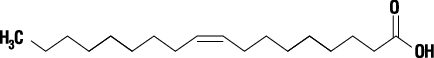
有効成分 | 1バイアル(10g)中 モノエタノールアミンオレイン酸塩 1.000g |
|---|---|
有効成分 | オレイン酸 0.822g |
有効成分 | モノエタノールアミン 0.178g |
添加剤 | 1バイアル(10g)中 ベンジルアルコール 0.4g |
| pH | 8.5~9.5※ |
|---|---|
| 浸透圧比 | 約0.4(生理食塩液に対する比)※ |
| 剤形・性状 | バイアル(無色ないし淡黄色の澄明で粘稠な注射液) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ポリドカノール製剤 | 同時投与を避けることが望ましい。1内視鏡治療で同時に使用すると、食道潰瘍、食道狭窄、胸水貯留の発現率が高くなることが報告されている。 | 同様の作用機序を有する。 |
5%以上 | 1~5%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|---|
血液 | 溶血注1) | 白血球増多、貧血(赤血球、ヘモグロビン、ヘマトクリットの減少)、血小板減少 | 白血球減少 | |
腎臓 | 肉眼的血色素尿、BUN、クレアチニンの上昇 | 蛋白尿 | ||
肝臓 | LDH、ビリルビンの上昇 | AST、ALTの上昇、アルブミン低下 | γ-GTP、ALP、尿ウロビリノーゲンの上昇、血清総蛋白低下 | |
食道 | 食道狭窄、食道潰瘍、食道静脈瘤注1) | 食道内巨大血腫、食道びらん・潰瘍出血 | 食道静脈瘤出血 | |
消化器 | 腹痛注1) | 出血性胃炎、胃・十二指腸潰瘍出血 | ||
胸部 | 胸痛 | 胸水貯留、縦隔炎 | ||
中枢神経系 | 血圧上昇、頭痛 | |||
循環器 | 血圧低下 | |||
筋肉 | CK上昇 | |||
その他 | 発熱 | 嘔気、心窩部痛 | 菌血症 |
希釈剤の種類 | 希釈剤としての適否 | |
注射用水 | 適 | |
生理食塩液 | 不適※ | |
血管造影用X線造影剤 | イオパミドール製剤 (ヨード含有量:300、370mg/mL) | 適 |
イオヘキソール製剤 (ヨード含有量:300、350mg/mL) | 適 | |
イオキサグル酸製剤 | 不適※ | |
イオベルソール製剤 (ヨード含有量:320、350mg/mL) | 不適※ | |
イオメプロール製剤 (ヨード含有量:300、350、400mg/mL) | 適 | |
イオプロミド製剤 (ヨード含有量:300、370mg/mL) | 不適※※ | |
評価時期 | 著効例数(%) | 有効例数(%) | 計例数(%) |
1~3カ月後 6カ月後 | 32(76.2) 20(54.1) | 10(23.8) 17(45.9) | 42(100) 37(100) |
レベル1(%) | レベル2(%) | レベル3(%) | レベル4(%) |
1(2.3) | 0(0.0) | 8(18.2) | 35(79.5) |
評価時期 | レベル1(%) | レベル2(%) | レベル3(%) | レベル4(%) |
1週間以内 (44例) | 2(4.5) | 0(0.0) | 11(25.0) | 31(70.5) |
治験終了時 (43例) | 1(2.3) | 1(2.3) | 1(2.3) | 40(93.0) |