1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ベバシズマブ(遺伝子組換え)(卵巣癌 10mg/kg 2週間間隔投与追加)
2
The CATT Research Group, et al. N Engl J Med. 2011;364:1897-908.
3
Curtis LH, et al. Arch Ophthalmol. 2010;128:1273-9.
4
Gower EW, et al. ARVO 2011 E-Abstract Poster 6644.
5
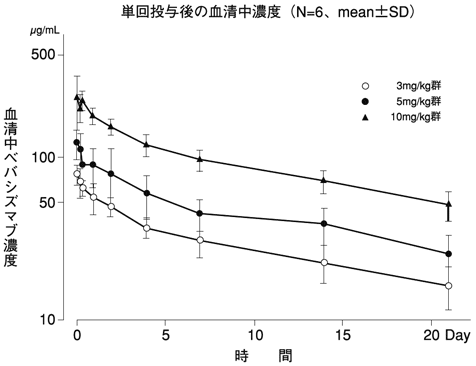
単回投与時の薬物動態(国内第Ⅰ相試験JO18157)(2007年4月18日承認、申請資料概要2.7.2.2.2.1)
6
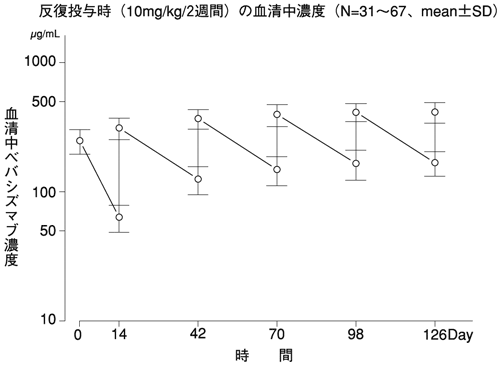
反復投与時の血中濃度(国内第Ⅱ相試験JO19901)(2011年9月26日承認、申請資料概要2.7.2.2)
7
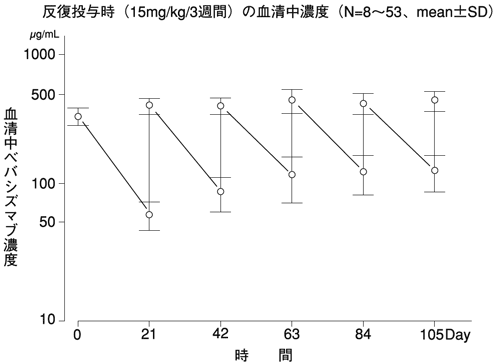
反復投与時の血中濃度(国内第Ⅱ相試験JO19907)(2011年9月26日承認、申請資料概要2.7.2.3)
8
ウサギ分布試験(2007年4月18日承認、申請資料概要2.6.4.4.1)
9
ウサギ排泄試験(2007年4月18日承認、申請資料概要2.6.4.6.1)
10
社内資料:国内第Ⅰ/Ⅱ相試験(JO19380試験)
11
社内資料:国内安全性確認試験(JO18158試験)
12
社内資料:国内第Ⅰ相試験(JO18157試験)
13
社内資料:海外第Ⅲ相比較試験(NO16966試験)
14
海外第Ⅲ相比較試験(E3200試験)(2007年4月18日承認、申請資料概要2.7.6.7)
15
海外第Ⅲ相比較試験(AVF2107g試験)(2007年4月18日承認、申請資料概要2.7.6.4)
16
社内資料:海外第Ⅲ相比較試験(AVF2107g試験)
17
海外第Ⅱ相比較試験(AVF2192g試験)(2007年4月18日承認、申請資料概要2.7.6.5)
18
社内資料:海外第Ⅱ相比較試験(AVF2192g試験)
19
Kabbinavar FF, et al. J Clin Oncol. 2005;23:3706-12.
20
社内資料:国内第Ⅱ相試験(JO19907試験)
21
Sandler A, et al. N Engl J Med. 2006;355:2542-50.
22
社内資料:海外第Ⅱ/Ⅲ相比較試験(E4599試験)
23
社内資料:海外第Ⅲ相比較試験(BO17704試験)
24
社内資料:海外第Ⅱ相比較試験(AVF0757g試験)
25
国内第Ⅱ相試験(JO19901試験)(2011年9月26日承認、申請資料概要2.7.6.6)
26
国内第Ⅱ相試験(JO19901試験)(2011年9月26日承認、申請資料概要2.7.4.2.1.1)
27
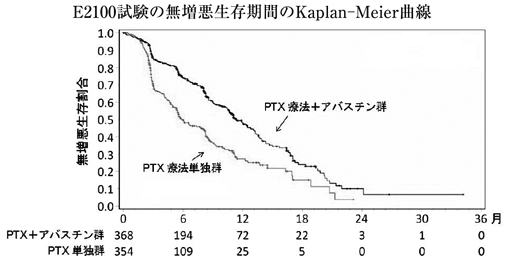
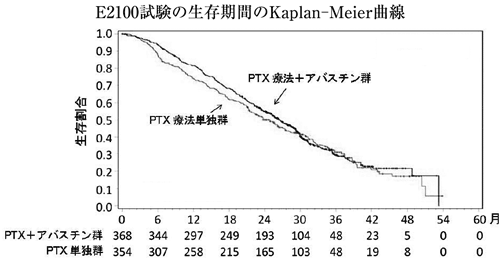
海外第Ⅲ相比較試験(E2100試験)(2011年9月26日承認、申請資料概要2.7.3.3)
28
社内資料:海外第Ⅲ相比較試験(E2100試験)
29
国内第Ⅱ相試験(JO22506試験)(2013年6月14日承認、申請資料概要2.7.6.1.3)
30
国内第Ⅱ相試験(JO22506試験)(2013年6月14日承認、申請資料概要(再発)2.7.4.2.1.1)
31
社内資料:国際共同第Ⅲ相比較試験(BO21990試験)
32
国際共同第Ⅲ相比較試験(BO21990試験)(2013年6月14日承認、申請資料概要(初発)2.7.4.2.1.1)
33
社内資料:国際共同第Ⅲ相比較試験(GOG-0218試験)
34
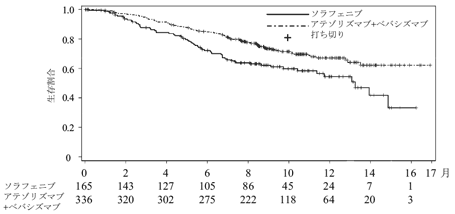
海外第Ⅲ相比較試験(GOG-0240試験)(2016年5月23日承認、申請資料概要2.7.6.1.1)
35
海外第Ⅲ相比較試験(GOG-0240試験)(2016年5月23日承認、申請資料概要2.7.6.2.1)
36
社内資料:国際共同第Ⅲ相試験(YO40245試験)
37
Ferrara N, et al. Nat Med. 2003;9:669-76.
38
Ferrara N, et al. Endocr Rev. 1997;18:4-25.
39
Presta LG, et al. Cancer Res. 1997;57:4593-9.
40
Willett CG, et al. Nat Med. 2004;10:145-7.
41
Gerber H-P, et al. Cancer Res. 2005;65:671-80.
42
Yanagisawa M, et al. Oncol Rep. 2009;22:241-7.
43
社内資料:ヒト肺癌xenograftモデルにおける抗腫瘍効果の検討
44
ヒト乳癌xenograftモデルにおける抗腫瘍効果の検討(2011年9月26日承認、申請資料概要2.6.2.2.1及び2.6.2.5.1)
45
ヒト膠芽腫xenograftモデルにおける抗腫瘍効果の検討(2013年6月14日承認、申請資料概要2.6.2.2.1及び2.6.2.5.1)