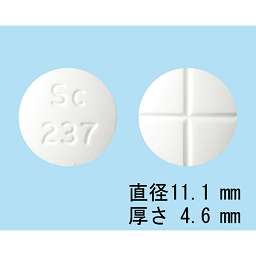
1
乾 正 他:精神医学. 1979;21(5):551-558
2
Maren TH, et al.:Bull Johns Hopkins Hosp. 1960;106:1-25
3
睡眠時無呼吸症候群研究会(執筆代表者 井上寛):神経精神薬理. 1987;9(7):493-513
4
三根 亨 他:臨床眼科. 1966;20(2):241-246
5
小林提樹 他:小児科診療. 1957;20(9):790-797
6
笹本 浩 他:日本内科学会雑誌. 1959;48(2):288-297
7
戸島洋一 他:呼吸と循環. 1986;34(1):69-74
8
井上雄一 他:自律神経. 1986;23(6):504-512
9
戸島洋一 他:日本胸部疾患学会誌. 1987;25(3):320-327
10
遠藤 馨 他:日本臨牀. 1957;15(9):1720-1727
11
蜂屋祥一 他:産婦人科の世界. 1959;11(8):1309-1313
12
切替一郎 他:治療. 1961;43(3):521-528