全身麻酔用鎮痛剤
1瓶 1825円
| 色調・性状 | 白色〜黄白色・粉末又は塊 |
|---|---|
| 剤形 | 用時溶解して用いる注射剤(凍結乾燥製剤) |
| pH | 本剤1バイアルに水2mLを加えて溶かした液のpHは2.5〜3.5である。 |
| 浸透圧比(生理食塩液に対する比) | 約1 (生理食塩液又は5%ブドウ糖注射液でレミフェンタニルとして100μg/mLに希釈したとき) |
| 色調・性状 | 白色〜黄白色・粉末又は塊 |
|---|---|
| 剤形 | 用時溶解して用いる注射剤(凍結乾燥製剤) |
| pH | 本剤1バイアルに水5mLを加えて溶かした液のpHは2.5〜3.5である。 |
| 浸透圧比(生理食塩液に対する比) | 約1 (生理食塩液又は5%ブドウ糖注射液でレミフェンタニルとして100μg/mLに希釈したとき) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| *ナルメフェン塩酸塩(セリンクロ) | *鎮痛作用が減弱するおそれがある。ナルメフェン塩酸塩を投与中の患者又は投与中止後1週間以内の患者には投与しないこと。緊急の手術等によりやむを得ず併用する場合には患者ごとに本剤の用量を漸増し、呼吸抑制等の中枢神経抑制症状を注意深く観察すること。手術等において本剤を投与することが事前にわかる場合には、少なくとも1週間前にナルメフェン塩酸塩の投与を中断すること。[「禁忌」の項参照] | *μオピオイド受容体への競合的阻害による。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制作用を有する薬剤3)(全身麻酔剤、ベンゾジアゼピン系薬剤、バルビツール酸系薬剤等) アルコール オピオイド剤 | 麻酔・鎮静等の作用が増強することがあるので、併用する場合には、投与速度を減速するなど慎重に投与すること。 | 相互に作用を増強させ過度な麻酔深度となるおそれがある。 |
| 心抑制作用を有する薬剤4)(β遮断剤、カルシウム拮抗剤等) | 徐脈、血圧低下等の作用が増強することがあるので、併用する場合には、投与速度を減速するなど慎重に投与すること。 | β遮断剤、カルシウム拮抗剤は共に徐脈、血圧低下作用を有するためこれらの薬剤との併用により作用が増強するおそれがある。 |
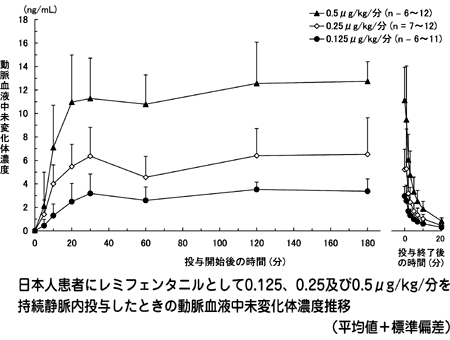
| 投与量 (μg/kg/分) | Cmax (ng/mL) | t1/2α (min) | t1/2β (min) | AUC (ng・min/mL) | CL (mL/min/kg) | Vss (mL/kg) |
| 0.125(n=11) | 3.08±0.94 | 1.30±0.77 | 12.62± 8.37 | 690.5±335.7 | 44.8±15.5 | 303±133 |
| 0.25(n=12) | 5.53±2.02 | 1.89±1.00 | 16.48±12.65 | 1235.4±703.7 | 55.4±35.1 | 406±296 |
| 0.5(n=12) | 11.23±2.99 | 1.59±0.86 | 15.01±11.04 | 1975.8±699.8 | 48.3±16.2 | 316±165 |
| 1.0(n=1) | 22.03 | 2.30 | 13.81 | 4978 | 45.4 | 296 |
| 用量(μg/kg/分) [n=1〜6歳、 7〜15歳] | 上段:中央値、下段:[範囲] 1〜6歳 | 上段:中央値、下段:[範囲] 7〜15歳 | 上段:中央値、下段:[範囲] 合計 | |
| 全血中未変化体 濃度(ng/mL) | <0.24注1) [n=1、0] | 5.01 - | - - | 5.01 - |
| 全血中未変化体 濃度(ng/mL) | 0.24〜0.26 [n=15、18] | 4.33 [0.57-6.38] | 5.41 [3.62-8.96] | 4.76 [0.57-8.96] |
| 全血中未変化体 濃度(ng/mL) | 0.26<注2) [n=2、0] | 11.18 [6.65-15.70] | - - | 11.18 [6.65-15.70] |
| CL (mL/min/kg) | 全用量 [n=18、18] | 57.51 [39.39-436.75] | 46.11 [27.71-69.45] | 51.18 [27.71-436.75] |
| 気管挿管時 | 気管挿管時 | 気管挿管時 | 皮膚切開時 | 皮膚切開時 | 皮膚切開時 | |
| 静脈麻酔剤 併用試験 | 吸入麻酔剤 併用試験 | 合計 | 静脈麻酔剤 併用試験 | 吸入麻酔剤 併用試験 | 合計 | |
| 対象例数 | 167 | 80 | 247 | 167 | 80 | 247 |
| 併用麻酔剤 | プロポフォール | プロポフォール | − | プロポフォール | セボフルラン | − |
| 反応 | 22(13.2) | 6(7.5) | 28(11.3) | 29(17.4) | 1(1.3) | 30(12.1) |
| 血行動態反応 | ||||||
| 収縮期血圧の上昇注1) | 19(11.4) | 3(3.8) | 22(8.9) | 27(16.2) | 1(1.3) | 28(11.3) |
| 心拍数の上昇注2) | 9(5.4) | 3(3.8) | 12(4.9) | 2(1.2) | 0(0) | 2(0.8) |
| 身体反応注3) | 0(0) | 1(1.3) | 1(0.4) | 0(0) | 0(0) | 0(0) |
| 自律神経性反応注4) | 0(0) | 1(1.3) | 1(0.4) | 0(0) | 0(0) | 0(0) |
| ASA分類別反応 | ||||||
| | 9/87(10.3) | 4/42(9.5) | 13/129(10.1) | 9/87(10.3) | 1/42(2.4) | 10/129(7.8) |
| | 12/78(15.4) | 2/33(6.1) | 14/111(12.6) | 19/78(24.4) | 0/33(0) | 19/111(17.1) |
| | 1/ 2(50.0) | 0/5(0) | 1/7(14.3) | 1/2(50.0) | 0/5(0) | 1/7(14.3) |