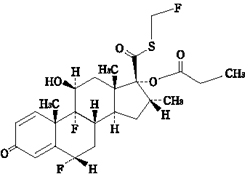
1
新保幸太郎他:薬理と治療, 1992;20:1597-1632
2
江崎洋志他:薬理と治療, 1992;20:1643-1656
3
Meibohm, B. et al.:Rev. Contemp. Pharmacother., 1998;9:535-549
4
奥田稔他:耳鼻と臨床, 1992;38(Suppl.1):420-430
5
Daniel, M. J. et al.:基礎と臨床, 1992;26:2011-2030
6
奥田稔他:耳鼻と臨床, 1992;38(Suppl.1):431-457
7
奥田稔他:耳鼻と臨床, 1993;39:66-85
8
奥田稔他:耳鼻と臨床, 1993;39:86-106
9
奥田稔他:耳鼻と臨床, 1993;39:107-127
10
奥田稔他:耳鼻と臨床, 1993;39:49-65
11
奥田稔他:耳鼻と臨床, 1992;38(Suppl.1):404-419
12
長谷川雅容他:アレルギー・免疫, 2006;13(6):882-894
13
Phillipps, G. H.:Respir. Med., 1990;84(Suppl.A):19-23
14
藤原肇他:基礎と臨床, 1992;26:1271-1295
15
大西正樹他:アレルギー, 1993;42:228-235