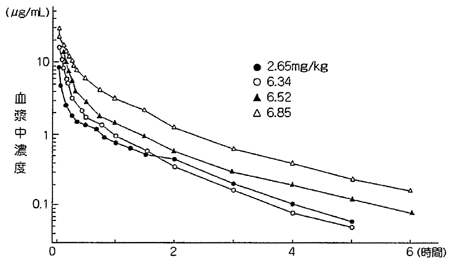
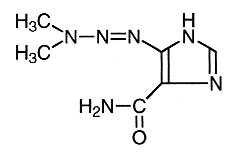
1
河原昌美, 他:臨床薬理. 2001;32(1):15-22
2
Koriech O. M., et al.:Clinical Radiology. 1981;32:53-55
3
Kulkarni S. S., et al.:Am J Clin Oncol. 1997;20(4):354-357
4
Bonadonna G., et al.:Cancer. 1975;36:252-259
5
Bhatia S., et al.:N Engl J Med. 1996;334(12):745-751
6
Breithaupt H., et al.:Cancer Chemother Pharmacol. 1982;9:103-109
7
Housholder G. E., et al.:J Pharmacol Exp Ther. 1971;179(2):386-395
8
Loo T. L., et al.:Cancer Res. 1968;28:2448-2453
9
Skibba J. L., et al.:Biochemical Pharmacology. 1970;19:2043-2051
10
DTIC研究グループ:臨床皮膚科. 1982;36(2):183-188
11
DTIC研究グループ:癌と化学療法. 1986;13(5):1940-1945
12
Takenaka T., et al.:Jpn J Clin Oncol. 2000;30(3):146-152
13
Canellos GP., et al.:N Engl J Med. 1992;327:1478-1484
14
Bono V. H.:Cancer Treatment Reports. 1976;60(2):141-148
15
社内資料:吾妻光彦, 他;DTICのメラノーマに対する抗腫瘍性
16
Montgomery J. A.:Cancer Treatment Reports. 1976;60(2):125-134
17
Venditti J. M.:Cancer Treatment Reports. 1976;60(2):135-140