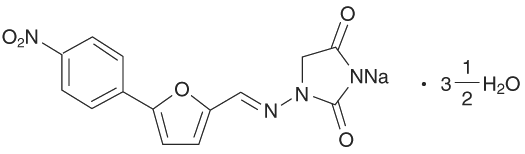
1
黒沢 敏 ほか:基礎と臨床, 1977; 11:3101-3120.[JP-H00393]
2
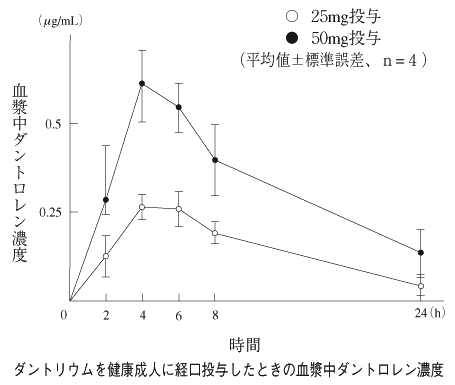
社内資料:健康成人・薬物動態[D197700205-02.00](昭和52年12月15日承認、申請資料概要IX.2.4, 3.3, 5.3.b)
3
里吉 営二郎 ほか:医学のあゆみ, 1978; 104:294-306.[JP-H01635A-B]
4
山脇 成人 ほか:基礎と臨床, 1993; 27:1045-1066.[DN-0509]
5
Ellis,K.O.et al.:Naunyn-Schmiedeberg's Arch. Pharmacol. 1972; 275:83-94.[DN-0473]
6
Ellis,K.O.et al.:Naunyn-Schmiedeberg's Arch. Pharmacol. 1972; 274:107-109.[DN-0474]
7
Takauji,M.et al.:Jpn.J.Physiol. 1975; 25:747-758.[DN-0475]
8
Brocklehurst,L.:Nature. 1975; 254:364.[DN-0477]
9
Ebashi,S.:Ann.Rev.Physiol. 1976; 38:293-313.[DN-0497]
10
高木 徳一:応用薬理, 1977; 13:525-538.[DN-0448]
11
Ellis,K.O.et al.:Arch.Phys.Med.Rehabil. 1974; 55:362-369.[DN-0479]
12
福田 英臣 ほか:応用薬理, 1977; 14:503-514.[JP-G05376]
13
加藤 匡宏 ほか:麻酔と蘇生, 1988; 24:179-185.[SJA-00986]
14
小山 司 ほか:神経化学, 1988; 27:308-309.[DN-0205]
15
小澤 由紀子 ほか:基礎と臨床, 1994; 28:2349-2354.[DN-0801]
16
Homma,I.et al.:Jpn.J.Physiol. 1976; 26:53-61.[DN-0476]
17
林 輝男 ほか:麻酔と蘇生, 1993; 29:21-24.[DN-0797]
18
加藤 匡宏 ほか:麻酔と蘇生, 1988; 24:301-307.[DN-0203]
19
山脇 成人 ほか:麻酔と蘇生, 1987; 23:159-163.[DN-0004]