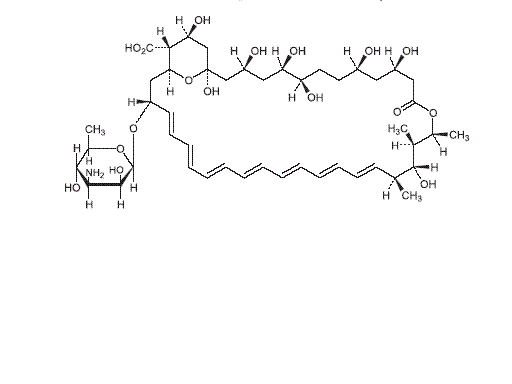
1
Jensen G. M., et al.: Clinica Chimica Acta. 2010; 411: 1900-1905
2
Walsh T. J., et al.: Antimicrob. Agents and Chemother. 1998; 42: 2391-2398
3
Johnson P. C., et al.: Annals of Internal Medicine. 2002; 137: E-105-E-110
4
社内資料: 内臓型リーシュマニア症における有効性
5
馬庭貴司ほか: 日薬理誌. 2007; 129: 129-134
6
竹本浩司ほか: 臨床と微生物. 2007; 34: 759-766
7
Takemoto K., et al.: Microbiol. Immunol. 2006; 50: 579-586
8
Takemoto K., et al.: J. Antimicrob. Chemother. 2004; 53: 311-317
9
Takemoto K., et al.: J. Antimicrob. Chemother. 2006; 57: 724-731
10
Takemoto K., et al.: Chemotherapy. 2006; 52: 271-278