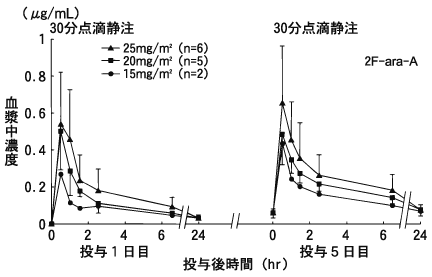
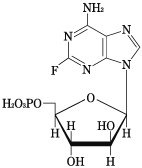
1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:フルダラビンリン酸エステル(再発又は難治性の急性骨髄性白血病)
2
有馬直道 他:癌と化学療法. 1999;26:619-29
3
Danhauser L, et al.:Cancer Chemother Pharmacol. 1986;18(2):145-52
4
社内資料:国内第I相試験(2007年1月26日承認、CTD2.5.3.1、2.7.2.3)
5
Reichelova V, et al.:J Liq Chromatogr. 1995;18:1123-35
6
Malspeis L, et al.:Semin Oncol. 1990;17:18-32
7
社内資料:腎機能低下患者における試験(1999年9月29日承認、申請資料概要へ-3.4)
8
Huang P, et al.:J Biol Chem. 1990;265:16617-25
9
Huang P, et al.:Molecular Pharmacology. 1991;39:449-55
10
Tseng W-C, et al.:Molecular Pharmacology. 1982;21:474-7
11
Sandoval A, et al.:Clin Cancer Res. 1996;2:1731-41
12
Rao V, et al.:Clin Cancer Res. 2003;9:3204-12
13
Yamauchi T, et al.:Clin Cancer Res. 2001;7:3580-9
14
社内資料:in vitro抗腫瘍効果(2007年1月26日承認、CTD2.6.2.1)
15
Clodi K, et al.:Br J Haematol. 1998;103:217-9
16
Di Gaetano N, et al.:Br J Haematol. 2001;114:800-9
17
Lathan B, et al.:Eur J Cancer Clin Oncol. 1988;24:1891-5
18
社内資料:in vivo抗腫瘍効果(2007年1月26日承認、CTD2.6.2.1)
19
Bai L, et al.:Oncol Rep. 2000;7:33-8
20
社内資料:in vivo抗腫瘍効果(2007年1月26日承認、CTD2.6.2.2)