1
Cockcroft DW, et al.: Nephron. 1976; 16: 31-41
2
社内資料: 複雑性尿路感染症又は腎盂腎炎の小児患者における二重盲検試験(外国人)(2015年9月24日承認、CTD2.7.6.22)
3
二木芳人他: 基礎と臨床. 1986; 20: 8903-8913
4
Roberge RJ, et al.: Ann Emerg Med. 2000; 36: 160-163
5
中川武正他: 炎症. 1995; 15: 337-338
6
安永幸二郎他: 基礎と臨床. 1997; 31: 2433-2466
7
東純一他: 基礎と臨床. 1997; 31: 2701-2725
8
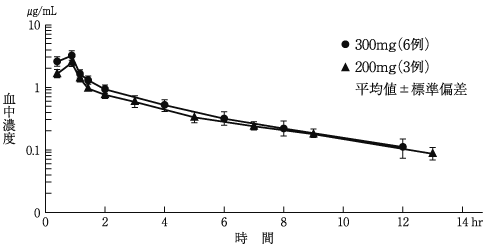
社内資料: 健康成人における薬物動態(外国人300及び400mg)(2015年9月24日承認、CTD2.7.6.1)
9
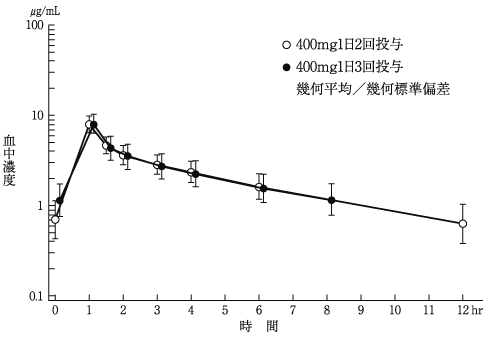
社内資料: 健康成人における薬物動態(外国人200及び400mg)(2015年9月24日承認、CTD2.7.6.2)
10
社内資料: 肺炎又は慢性呼吸器病変の二次感染の日本人患者における高用量の非盲検試験(2015年9月24日承認、CTD2.7.6.28)
11
安永幸二郎他: 基礎と臨床. 1997; 31: 2503-2512
12
原耕平他: 日化療会誌. 1997; 45: 923-935
13
小林宏行他: 日化療会誌. 1997; 45: 846-871
14
相川直樹他: 日化療会誌. 1997; 45: 936-950
15
Bergan T: Diag Microbiol Infect Dis. 1990; 13: 103-114
16
Shah A, et al.: J Antimicrob Chemother. 1996; 38: 103-116
17
社内資料: 血液透析患者における薬物動態(外国人)
18
社内資料: 小児患者における薬物動態(外国人)
19
原耕平他: 日化療会誌. 1997; 45: 901-922
20
社内資料: 嚢胞性線維症の小児患者における二重盲検試験(外国人)(2015年9月24日承認、CTD2.7.6.24)
21
山下悟他: Chemotherapy. 1985; 33(S-7): 1-17
22
社内資料: キノロン系抗菌剤Ciprofloxacinに関するin vitro抗菌力
23
社内資料: 新キノロン系合成抗菌剤Ciprofloxacinの試験管内抗菌力
24
社内資料: Ciprofloxacinに関する細菌学的評価
25
Saito A, et al.: J Antimicrob Chemother. 1986; 18: 251-260
26
山口惠三他: Jpn J Antibiotics. 2008; 61: 241-268
27
Takesue Y, et al.: J Infect Chemother. 2012; 18: 816-826
28
西野武志他: Chemotherapy. 1996; 42: 140-145
29
Friedlander AM, et al.: J Inf Dis. 1993; 167: 1239-1243