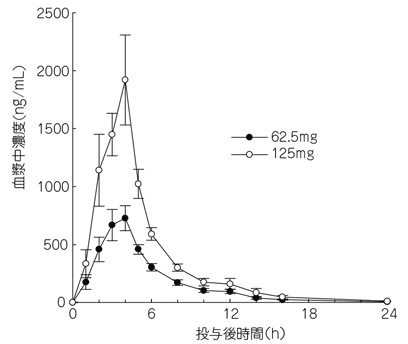
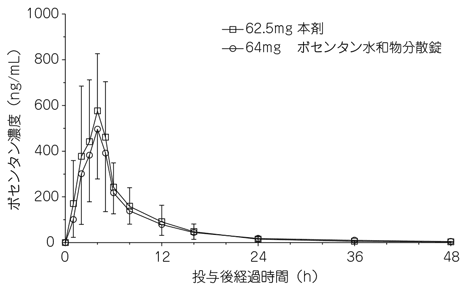
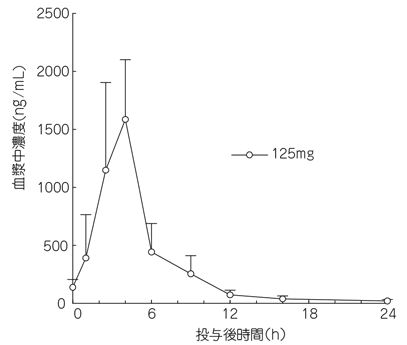
1
Van Giersbergen PLM, et al.:J Clin Pharmacol. 2005;45:42-47
2
Gutierrez MM, et al.:Int J Clin Pharmacol Ther. 2013;51:529-536
3
社内資料:健康成人を対象とした反復投与試験(2005年4月11日承認、申請資料概要ト2.1)
4
社内資料:日本人肺動脈性肺高血圧症患者を対象とした薬物動態試験(2012年11月21日承認、CTD2.7.2.2)
5
社内資料:肺動脈性肺高血圧症患者を対象とした長期投与試験における薬物動態(2005年4月11日承認、申請資料概要ト1.5)
6
Dingemanse J, et al.:J Clin Pharmacol. 2002;42:283-289
7
社内資料:In vitro血漿蛋白結合率の検討(2005年4月11日承認、申請資料概要ヘ2.2)
8
Weber C, et al.:Drug Metab Disp. 1999;27:810-815
9
Van Giersbergen PLM, et al.:J Clin Pharmacol. 2003;43:15-22
10
Dingemanse J, et al.:Int J Clin Pharmacol Ther. 2002;40:310-316
11
Binet I, et al.:Kidney International. 2000;57:224-231
12
Van Giersbergen PLM, et al.:Clin Pharmacol Ther. 2002;71:253-262
13
Weber C, et al.:J Clin Pharmacol. 1999;39:847-854
14
Van Giersbergen PLM, et al.:Br J Clin Pharmacol. 2002;53:589-595
15
Dingemanse J, et al.:Clin Pharmacokinet. 2003;42:293-301
16
Van Giersbergen PLM, et al.:Clin Pharmacol Ther. 2007;81:414-419
17
Van Giersbergen PLM, et al.:Int J Clin Pharmacol Ther. 2006;44:113-118
18
Burgess G, et al.:Eur J Clin Pharmacol. 2008;64:43-50
19
Channick R, et al.:Lancet. 2001;358:1119-1123
20
Rubin LJ, et al.:N Engl J Med. 2002;346:896-903
21
Galie N, et al.:Lancet. 2008;371:2093-2100
22
Sasayama S, et al.:Circ. J 2005;69:131-137
23
Hatano M, et al.:Heart Vessels. 2015:30:798-804
24
社内資料:全身性強皮症に続発する虚血性手指潰瘍の予防に関する探索的二重盲検無作為化プラセボ対照試験(2015年8月24日承認、CTD2.7.6.2)
25
Matucci-Cerinic M, et al.:Ann Rheum Dis. 2011;70:32-38
26
Hamaguchi Y, et al.:J Dermatol. 2017;44(1):13-17
27
Clozel M, et al.:J Pharmacol Exp Ther. 1994;270:228-235
28
社内資料:ラット血管平滑筋細胞を用いた検討(2005年4月11日承認、申請資料概要ホ1.1)
29
社内資料:ラット気管平滑筋細胞を用いた検討(2005年4月11日承認、申請資料概要ホ1.1)
30
Wang QD, et al.:J Cardiovasc Pharmacol. 1995;26:S445-S447
31
Richard V, et al.:Circulation. 1995;91:771-775
32
Porter KE, et al.:J Vasc Surg. 1998;28:695-701
33
Verma S, et al.:Cardiovasc Res. 2001;49:146-151
34
Dumont AS, et al.:J Neurosurg. 2001;94:281-286
35
Sato S et al.:難治性疾患克服研究事業 全身性強皮症における病因解明と根治的治療法の開発(平成23年度)総括・分担研究報告書
36
Akamata K, et al.:Arthritis Res Ther. 2014;16:R86
37
Chen SJ, et al.:J Appl Physiol. 1995;79:2122-2131
38
Karam H, et al.:Cardiovascular Research. 1996;31:287-295
39
Park SH, et al.:Am J Respir Crit Care Med. 1997;156:600-608