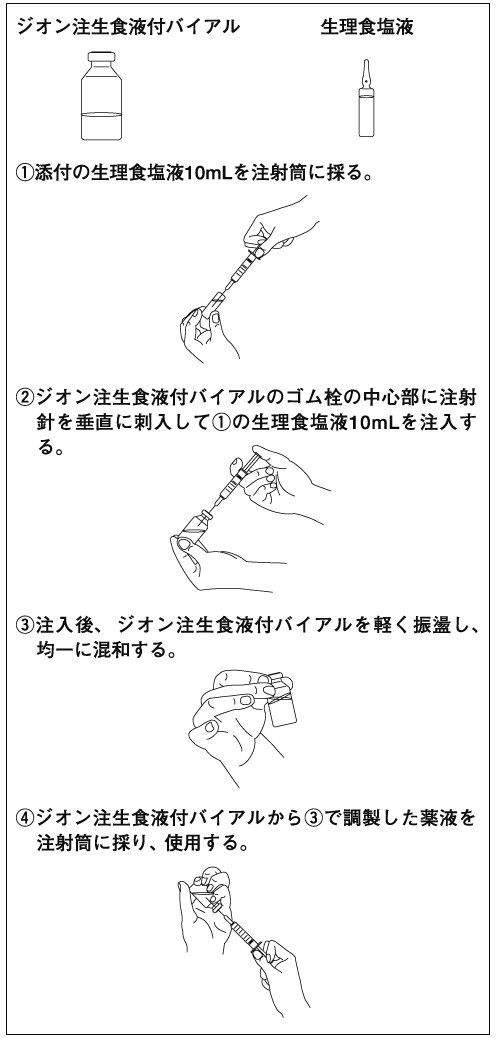
1
高村 寿雄 他:薬理と治療. 2004; 32(6): 355-365
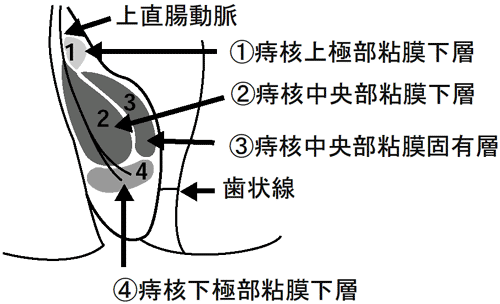
2
高村 寿雄 他:薬理と治療. 2004; 32(6): 367-377
3
Takano, M. et al.: Int. J. Colorectal Dis. 2006; 21: 44-51
4
Ono, T. et al.: J. Pharmacol. Sci. 2005; 99: 353-363
5
Ono, T. et al.: J. Pharmacol. Sci. 2006; 102: 314-320
内痔核硬化療法剤
1瓶 4592円
有効成分 | 日局 硫酸アルミニウムカリウム水和物 400mg(4w/v%) |
|---|---|
有効成分 | タンニン酸 14mg(0.14w/v%) |
添加剤 | クエン酸ナトリウム水和物 150mg デキストラン40 70mg グリセリン 1000mg 亜硫酸水素ナトリウム 15mg |
| pH | 2.2~2.9 |
|---|---|
| 性状 | 微黄色~淡黄色澄明の液で僅かに粘性がある |
| 調製後の性状(本品1バイアルに添付の生理食塩液10mLを加えて硫酸アルミニウムカリウム水和物として2%溶液に調製) | |
| pH | 約3 |
|---|---|
| 浸透圧比 | 約3(生理食塩液に対する比) |
| 外観 | 無色~淡黄色澄明の液 |
5%以上 | 1~5%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|---|
血液 | リンパ球減少、好中球増加、白血球数上昇 | 好酸球増加、APTT延長 | 単球増加、赤血球数低下、ヘモグロビン減少、プロトロンビン時間延長 | |
皮膚・粘膜 | 蕁麻疹 | |||
腎・泌尿器 | 尿中β2マイクログロブリン上昇 | 尿酸上昇、尿糖陽性化、尿潜血陽性化、尿中NAG上昇 | 頻尿、血尿、多尿、BUN上昇・減少、尿蛋白陽性化、尿ウロビリノゲン上昇、血清カリウム上昇 | 尿閉 |
循環器 | 徐脈、血圧低下 | |||
消化器 | 下痢、食欲不振、嘔気 | 不快感、胃潰瘍 | 下腹部痛、嘔吐 | |
肝臓 | 総ビリルビン上昇、AST上昇、ALT上昇、ALP上昇、γ-GTP上昇 | アルブミン低下、A/G比低下、トリグリセライド上昇、LDH上昇 | ||
精神神経系 | 頭痛 | |||
その他 | 発熱、CRP上昇(12%) | 全身倦怠(感)、血栓形成性痔核 | 肛門不快感、頚肩痛、熱感 | 肛門周囲膿瘍、直腸周囲膿瘍、直腸炎、肛門浮腫、肛門周囲炎、肛門縁腫脹、肛門出血 |
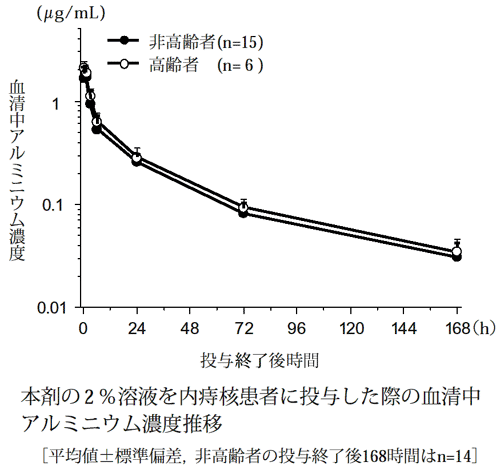
(平均値±標準偏差) | |||||||
被験者a) | 投与液量b) (mL) | 投与量c) (mg/kg) | tmax (h) | Cmax (μg/mL) | t1/2(24-168h) (h) | AUC0-24h (μg・h/mL) | AUC0-∞ (μg・h/mL) |
非高齢者d) | 33.5 (27~42) | 10.7 (8.4~13.7) | 0.71±0.37 | 1.80±0.51 | 49.7±9.9f) | 13.8±3.7 | 30.1±5.1f) |
高齢者e) | 37.8 (34~41) | 13.1 (10.4~16.3) | 0.25±0.00 | 2.09±0.33 | 48.8±5.1 | 16.0±2.6 | 33.7±5.9 |
評価項目 | 局所麻酔剤による調製注) |
1%プロカイン塩酸塩注射液 | |
脱出 | 100% (15/15) |
排便時出血 | 92% (11/12) |
痔核の 大きさ※1 | 93% (14/15) |
評価項目 | 局所麻酔剤による調製注) | 生理食塩液 による調製 | 合計 |
0.5%リドカイン注射液 | |||
脱出 | 92% (44/48) | 96% (53/55) | 94% (97/103) |
排便時出血 | 88% (21/24) | 100% (30/30) | 94% (51/54) |
痔核の 大きさ※1 | 56% (27/48) | 60% (33/55) | 58% (60/103) |
評価項目 | 局所麻酔剤による調製注) |
0.5%リドカイン注射液 | |
脱出 | 100% (6/6) |
排便時出血 | 100% (3/3) |
痔核の 大きさ※1 | 100% (6/6) |