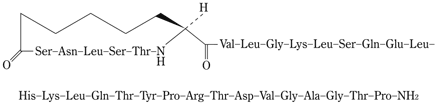
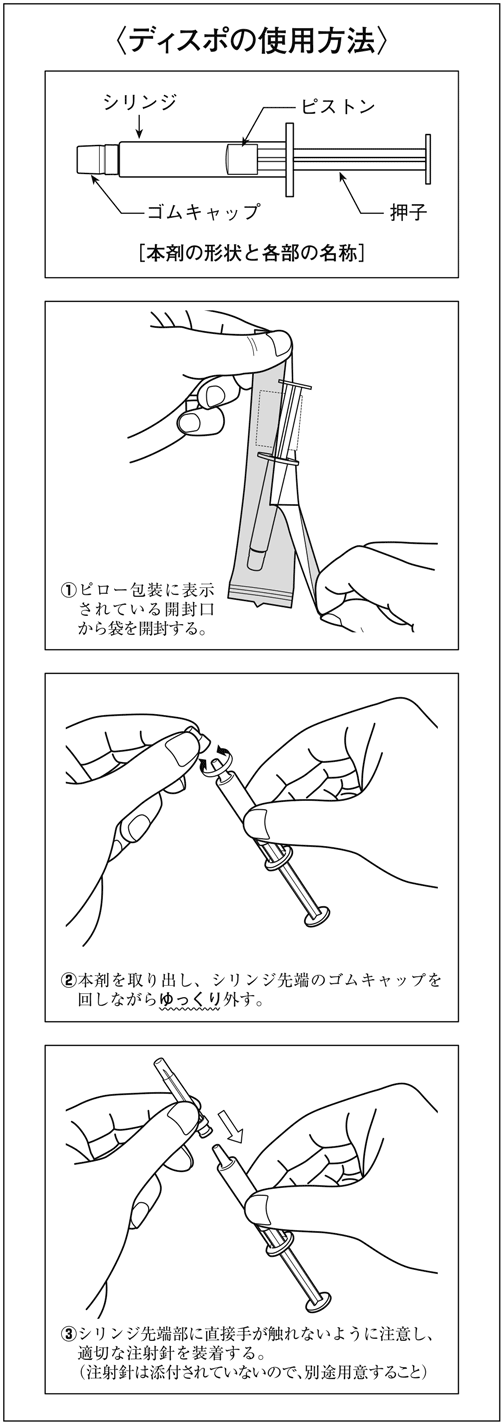
1
European Medicines Agency.“Assessment report for calcitonin containing medicinal products”.
2
U.S. Food and Drug Administration.“Background Document for Meeting of Advisory Committee for Reproductive Health Drugs and Drug Safety and Risk Management Advisory Committee”.
3
社内資料:骨粗鬆症に対するエルカトニンの市販後臨床試験
4
社内資料:原発性骨粗鬆症に対するエルカトニンの臨床試験
5
社内資料:エルカトニンのラットにおける皮下投与による12ヶ月慢性毒性試験
6
社内資料:92 week subcutaneous carcinogenicity study in mice
7
社内資料:薬物動態<血中濃度>
8
社内資料:薬物動態<体内分布、排泄>
9
墳本 敏彦他:現代の診療.1978;20(12):2223-2227
10
藤田 拓男他:医学のあゆみ.1990;152(4):261-282
11
社内資料:臨床成績<最終自覚症状改善度>
12
Ito A. et al.:Mol. Pain.2012;8:42
13
Ito A. et al.:J. Neurosci. 2000;20(16):6302-6308
14
Yamazaki N. et al.:Jpn. J. Pharmacol.1999;81:367-374
15
Ito A. et al.:Mol. Pain. 2017;13
16
Umeno H. et al.:Pharmacol. Biochem. Behav.1996; 55(1): 151-156
17
Shibata K. et al.:Pharmacol. Biochem. Behav.1998;60:371-376
18
伊藤 彰敏:Osteoporosis Jpn.2007;15(3):507-509
19
伊藤 彰敏:Osteoporosis Jpn.2005;13(S-1):183-183