1
社内資料:Bezafibrateのマウスにおける18カ月間の慢性経口投与癌原性試験[文献参照番号][35955]
2
社内資料:Bezafibrateの慢性経口投与癌原性試験 ラットでの2年間投与試験(その1)[文献参照番号][35956]
3
社内資料:Bezafibrateの慢性経口投与癌原性試験 ラットでの2年間投与試験(その2)[文献参照番号][35957]
4
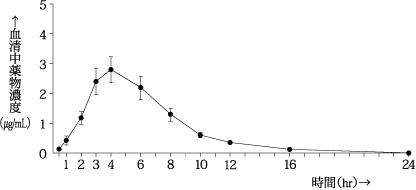
社内資料:健康成人を対象とした臨床薬理試験[単回投与][文献参照番号][76639]
5
社内資料:健康成人を対象とした臨床薬理試験[連続投与][文献参照番号][76640]
6
社内資料:健康成人を対象とした第I相臨床試験[文献参照番号][76638]
7
秦葭哉ほか:Geriatr Med. 1989;27(2):225-270[文献参照番号][08829]
8
草間寛ほか:日本薬理学雑誌. 1988;92(3):181-191[文献参照番号][08820]
9
Blasi, F. et al.:Pharmacol. Res. 1989;21(3):247-254[文献参照番号][10331]
10
佐々木淳ほか:臨床医薬. 1988;4(11):2121-2136[文献参照番号][08835]
11
Stewart, J. M. et al.:Atherosclerosis. 1982;44(3):355-365[文献参照番号][08908]
12
中谷矩章ほか:臨床医薬. 1988;4(10):1779-1809[文献参照番号][08828]
13
草間寛ほか:日本薬理学雑誌. 1988;92(3):175-180[文献参照番号][08817]