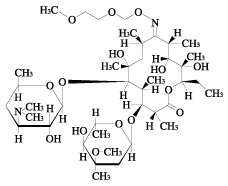
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
小山 優 他:Chemotherapy. 1988;36(S-4):164-83
3
Yamazaki H, et al.:Xenobiotica. 1996;26(11):1143-53
4
稲松孝思 他:Chemotherapy. 1988;36(S-4):184-90
5
Obach R S, et al.:J Pharmacol Exp Ther. 2006;316(1):336-48
6
Backman J T, et al.:Eur J Clin Pharmacol. 1994;46(6):551-5
7
野原 望 他:感染症学雑誌. 1989;63:203-27
8
河村正三 他:耳鼻と臨床. 1989;35:285-307
9
副島林造 他:感染症学雑誌. 1989;63:501-29
10
河村正三 他:耳鼻と臨床. 1989;35:103-12
11
馬場駿吉 他:耳鼻と臨床. 1989;35:314-40
12
佐々木次郎 他:Jpn J Antibiot. 1989;42:1233-55
13
赤松浩彦 他:西日本皮膚科. 1997;59:451-5
14
荒田次郎 他:西日本皮膚科. 1997;59:444-50
15
横田 健 他:Chemotherapy. 1988;36(S-4):35-52
16
坪井 靖 他:Chemotherapy. 1988;36(S-4):1-17
17
村岡宏昭 他:Chemotherapy. 1988;36(S-4):18-34
18
加藤直樹 他:Chemotherapy. 1988;36(S-4):65-75
19
眞崎美矢子 他:Chemotherapy. 1988;36(S-4):421-37