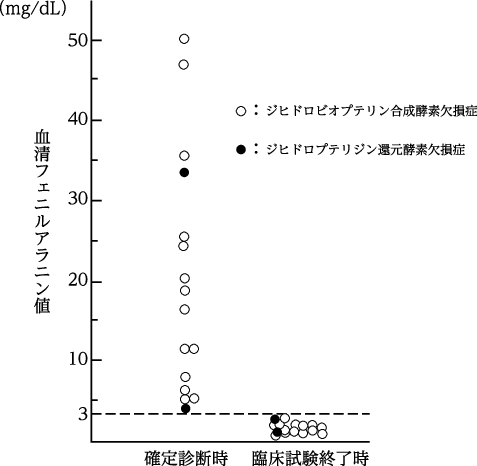
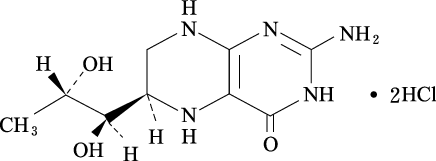
1
日本先天代謝異常学会-新生児マススクリーニング対象疾患等診療ガイドライン 2019:11-24
2
社内資料:健康成人におけるサプロプテリン塩酸塩の体内動態(1992年3月27日承認、CTD2.7.2.2)
3
社内資料:薬物動態に及ぼす食事の影響(1992年3月27日承認、CTD2.7.2.3)
4
林 敏郎ほか:基礎と臨床 1992;26(8):3471-3495
5
社内資料:ヒトにおける血漿蛋白結合率(1992年3月27日承認、CTD2.7.2.2)
6
Curtius HC, et al.:Clin Chim Acta. 1979;93(2):251-262
7
北川照男ほか:小児内科 1990;22(11):1737-1750
8
松原洋一ほか:特殊ミルク情報 2002;(38):44-59
9
Levy HL, et al.:Lancet 2007;370(9586):504-510
10
弘津一郎ほか:応用薬理 1992;43(6):549-553
11
藤岡雅司:大阪市医学会雑誌 1992;41(2):553-568
12
Miwa S, et al.:Arch Biochem Biophys. 1985;239(1):234-241