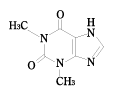
| 販売名 | テオロング錠50mg |
|---|---|
| 剤形 | 徐放錠 |
| 識別コード |  TE50 TE50 |
| 外形:表 |  |
| 外形:裏 |  |
| 外形:側面 |  |
| 直径 | 7.1mm |
| 質量 | 135mg |
| 厚さ | 3.3mm |
| 性状 | 白色 徐放顆粒による斑点模様を有する |

| 販売名 | テオロング錠100mg |
|---|---|
| 剤形 | 徐放錠 |
| 識別コード |  TE100 TE100 |
| 外形:表 |  |
| 外形:裏 |  |
| 外形:側面 |  |
| 直径 | 8.1mm |
| 質量 | 235mg |
| 厚さ | 4.2mm |
| 性状 | 白色 徐放顆粒による斑点模様を有する |

| 販売名 | テオロング錠200mg |
|---|---|
| 剤形 | 徐放錠 |
| 識別コード |  TE200 TE200 |
| 外形:表 |  |
| 外形:裏 |  |
| 外形:側面 |  |
| 直径 | 10.1mm |
| 質量 | 470mg |
| 厚さ | 5.5mm |
| 性状 | 白色 徐放顆粒による斑点模様を有する |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **アデノシン (アデノスキャン) | 本剤によりアデノシンによる冠血流速度の増加及び冠血管抵抗の減少を抑制し、虚血診断に影響を及ぼすことがある。アデノシン(アデノスキャン)を投与する場合は12時間以上の間隔をあけること。 | 本剤はアデノシン受容体に拮抗するため、アデノシンの作用を減弱させる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 他のキサンチン系薬剤 アミノフィリン水和物 コリンテオフィリン ジプロフィリン カフェイン水和物等 中枢神経興奮薬 エフェドリン塩酸塩 マオウ等 | 過度の中枢神経刺激作用があらわれることがある。(「過量投与」の項参照) 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | 併用により中枢神経刺激作用が増強される。 |
| 交感神経刺激剤 (β刺激剤) イソプレナリン塩酸塩 クレンブテロール塩酸塩 ツロブテロール塩酸塩 テルブタリン硫酸塩 プロカテロール塩酸塩水和物等 | 低カリウム血症、心・血管症状(頻脈、不整脈等)等のβ刺激剤の副作用症状を増強させることがある。 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | 心刺激作用をともに有しており、β刺激剤の作用を増強するためと考えられる。 低カリウム血症の増強についての機序は不明である。 |
| ハロタン | 不整脈等の副作用が増強することがある。また、連続併用によりテオフィリン血中濃度が上昇することがある。 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | テオフィリンとハロタンの心臓に対する作用の相加又は相乗効果と考えられる。 |
| ケタミン塩酸塩 | 痙攣があらわれることがある。 痙攣の発現に注意し、異常が認められた場合には抗痙攣剤の投与など適切な処置を行うこと。 | 痙攣閾値が低下するためと考えられる。 |
| シメチジン メキシレチン塩酸塩 プロパフェノン塩酸塩 アミオダロン塩酸塩 エノキサシン水和物 ピペミド酸水和物 塩酸シプロフロキサシン ノルフロキサシン トスフロキサシントシル酸塩水和物 パズフロキサシンメシル酸塩 プルリフロキサシン エリスロマイシン クラリスロマイシン ロキシスロマイシン チアベンダゾール チクロピジン塩酸塩 ベラパミル塩酸塩 ジルチアゼム塩酸塩 フルボキサミンマレイン酸塩 フルコナゾール ジスルフィラム デフェラシロクス | テオフィリンの中毒症状があらわれることがある。(「過量投与」の項参照) 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | 肝薬物代謝酵素が阻害され、テオフィリンクリアランスが低下するため、テオフィリン血中濃度が上昇すると考えられる。 |
| アシクロビル バラシクロビル塩酸塩 インターフェロン イプリフラボン シクロスポリン アロプリノール | テオフィリンの中毒症状があらわれることがある。(「過量投与」の項参照) 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | テオフィリン血中濃度の上昇によると考えられる。 |
| ザフィルルカスト | テオフィリンの中毒症状があらわれることがある。(「過量投与」の項参照) 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 また、ザフィルルカストの血中濃度を低下させることがある。 | 肝薬物代謝酵素が阻害され、テオフィリンクリアランスが低下するため、テオフィリン血中濃度が上昇すると考えられる。 ザフィルルカストの血中濃度低下についての機序は不明である。 |
| リファンピシン フェノバルビタール ランソプラゾール リトナビル | テオフィリンの効果が減弱することがある。 テオフィリン血中濃度が低下することがあるので、適切な処置を行うこと。 | 肝薬物代謝酵素の誘導によりテオフィリンクリアランスが上昇するため、テオフィリン血中濃度が低下すると考えられる。 |
| フェニトイン カルバマゼピン | テオフィリン及び相手薬の効果が減弱することがある。 テオフィリン血中濃度が低下することがあるので、適切な処置を行うこと。 また、相手薬の効果減弱や血中濃度の低下に注意すること。 | 肝薬物代謝酵素の誘導によりテオフィリンクリアランスが上昇するため、テオフィリン血中濃度が低下すると考えられる。 |
| ジピリダモール | ジピリダモールの作用を減弱させることがある。 | アデノシン拮抗作用による。 |
| ラマトロバン | ラマトロバンの血中濃度が上昇することがある。 | ラマトロバンの血中濃度上昇についての機序は不明である。 |
| リルゾール | リルゾールの作用を増強(副作用発現)するおそれがある。 | in vitro試験でリルゾールの代謝を阻害することが示唆されている。 |
| タバコ | 禁煙(禁煙補助剤であるニコチン製剤使用時を含む)によりテオフィリンの中毒症状があらわれることがある。(「過量投与」の項参照) 副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | 喫煙により肝薬物代謝酵素が誘導され、テオフィリンクリアランスが上昇し、テオフィリン血中濃度が低下すると考えられる。また、禁煙により血中濃度が上昇すると考えられる。 |
| セイヨウオトギリソウ(St. John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の代謝が促進され血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウにより誘導された肝薬物代謝酵素が本剤の代謝を促進し、クリアランスを上昇させるためと考えられている。 |
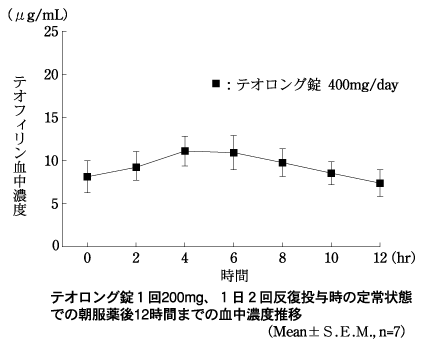
| AUC0-12 (μg・hr/mL) | MRT0-12 (hr) | tmax (hr) | Cmax (μg/mL) | Cmin (μg/mL) | ΔC (μg/mL) | Cave (μg/mL) |
| 132.7±27.4 | 5.9±0.2 | 4.9±1.5 | 12.58±2.42 | 7.48±2.23 | 5.09±0.88 | 10.16±2.07 |
| 食事 | AUC0-12 (μg・hr/mL) | MRT0-12 (hr) | tmax (hr) | Cmax (μg/mL) | Cmin (μg/mL) | ΔC (μg/mL) | Cave (μg/mL) |
| 摂食時 | 134.9±23.9 | 6.0±0.2 | 4.7±1.2 | 13.18±1.75 | 8.42±2.71 | 4.77±0.98 | 10.96±2.31 |
| 絶食時 | 126.0±20.7 | 5.8±0.3 | 4.7±1.2 | 12.85±1.07 | 7.11±2.06 | 5.74±1.03 | 10.08±2.43 |
| 対象(症例数) | 有用度(%):有用以上 | 有用度(%):やや有用以上 |
| 気管支喘息:小児(284例) | 73.6% | 91.2% |
| 気管支喘息:成人(242例) | 59.9% | 83.9% |
| 慢性気管支炎(22例) | 45.5% | 86.4% |
| 肺気腫(5例) | 40.0% | 60.0% |