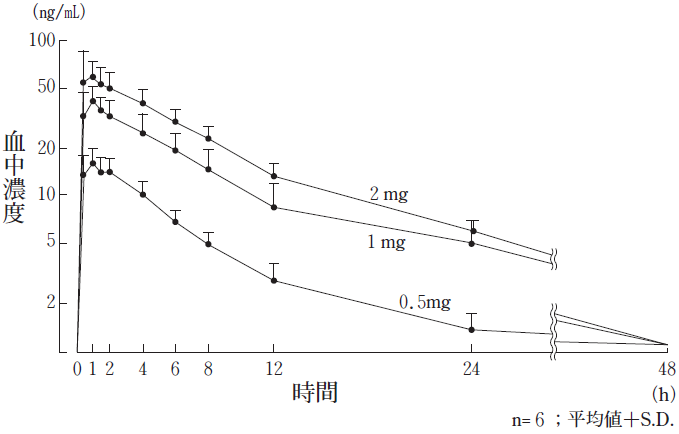
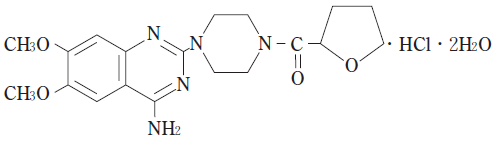
1
海老原昭夫, 他: 臨床医薬. 1987; 3(6): 667-679
2
内出政之, 他: 薬理と治療. 1987; 15(4): 1513-1524
3
Kyncl JJ, et al.: New Cardiovascular Drugs. 1986; 1-18
4
金子好宏, 他: 臨床と研究. 1988; 65(1): 242-277
5
吉永 馨, 他: 薬理と治療. 1988; 16(3): 1245-1266
6
武田忠直, 他: 薬理と治療. 1987; 15(7): 2861-2886
7
吉永 馨, 他: 薬理と治療. 1987; 15(7): 2835-2860
8
池田正男, 他: 薬理と治療. 1987; 15(7): 2887-2919
9
吉永 馨, 他: 医学と薬学. 1987; 17(5): 1242-1257
10
高畠利一, 他: 医学と薬学. 1991; 25(5): 1367-1377
11
熊本悦明, 他: 泌尿器外科. 1992; 5(8): 721-734
12
熊本悦明, 他: 泌尿器外科. 1992; 5(9): 823-840
13
朴 英哲, 他: 泌尿紀要. 1992; 38(7): 857-868
14
熊本悦明, 他: 泌尿器外科. 1992; 5(9): 841-848
15
中村昌平, 他: 泌尿器外科. 1992; 5(5): 447-451
16
Nagatomo T, et al.: Chem Pharm Bull (Tokyo). 1987; 35(4): 1629-1632
17
花塚光男, 他: 日薬理誌. 1986; 88(6): 433-441
18
Yamada S, et al.: Life Sci. 1992; 50(2): 127-135
19
溝上 進, 他: 応用薬理. 1987; 33(1): 81-90
20
堀井大治郎, 他: 応用薬理. 1987; 33(1): 165-169
21
森田 隆: J Smooth Muscle Res. 1991; 27(3): 149-154
22
供田文宏, 他: 循環の計測と制御. 1986; 5(1): 22-29