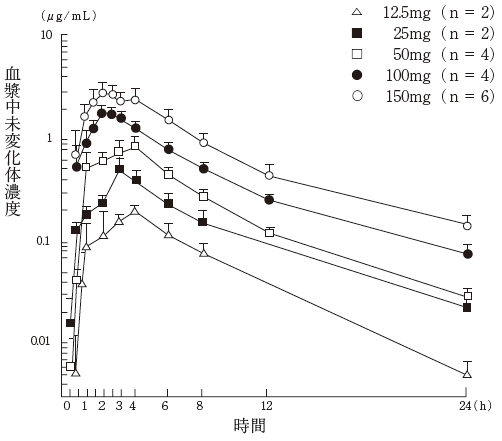
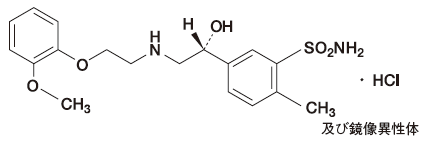
1
Nakashima, M. et al.: Clin. Pharmacol. Ther. 1984; 36(4): 436-443[LO-0109]
2
Kamimura, H. et al.: Xenobiotica. 1985; 15(5): 413-420[LO-0104]
3
池田正男 他: 医学のあゆみ 1986; 139(6): 425-453[LO-0007]
4
池田正男 他: 基礎と臨床 1986; 20(1): 219-227[LO-0005]
5
竹田亮祐 他: 臨床医学 1985; 1(8): 1091-1102[LO-0075]
6
荒川正昭 他: 基礎と臨床 1985; 19(12): 6157-6174[LO-0009]
7
大石誠一 他: 臨床と研究 1987; 64(7): 2247-2250[LO-0061]
8
大橋輝久 他: 西日本泌尿器科 1986; 48(4): 1461-1465[LO-0064]
9
本田一男 他: 基礎と臨床 1988; 22(5): 899-921[LO-0026]
10
Honda, K. et al.: Jpn. J. Pharmacol. 1985; 38(1): 31-41[LO-0084]
11
Takenaka, T. et al.: Eur. J. Pharmacol. 1982; 85: 35-50[LO-0105]
12
Asano, M. et al.: Arch. Int. Pharmacodyn. Ther. 1983; 262: 34-46[LO-0111]
13
Honda, K. et al.: J. Pharmacol. Exp. Ther. 1986; 236(3): 776-783[LO-0106]
14
内田 渡 他: 基礎と臨床 1986; 20(11): 5928-5934[LO-0065]
15
斉藤俊弘 他: 基礎と臨床 1985; 19(13): 6541-6544[LO-0077]
16
和泉玲子 他: 応用薬理 1985; 29(6): 863-871[LO-0083]
17
太田敬史 他: 基礎と臨床 1986; 20(11): 6028-6034[LO-0063]







 005
005