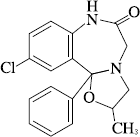
1
棚瀬久雄 他:三共研究所年報.1969;21:107-119
2
Yamazaki, Y. et al.:三共研究所年報.1980;32:104-113
3
Shindo, H. et al.:Chem Pharm Bull.1971;19(1):60-71
4
金子仁郎 他:医学のあゆみ.1970;74(6):292-302
5
大熊文男:医学のあゆみ.1970;72(4):200-207
6
村崎光邦:臨床精神医学.2000;29(増刊号):137-144
7
酒井豊 他:日本薬理学雑誌.1970;66(6):706-722
8
高木弘 他:日本薬理学雑誌.1970;66(1):107-133
9
石川亀一:臨牀と研究.1970;47(3):714-716