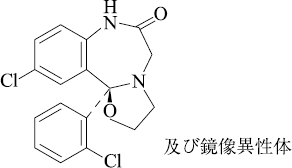
1
Murata, H. et al.:Chem Pharm Bull.1973;21(2):404-414
2
萩原信義 他:薬物療法.1972;5(5):1059-1069
3
金子嗣郎:薬物療法.1972;5(5):1015-1027
4
東 雄司 他:薬物療法.1972;5(6):1305-1311
5
井出 毅:新薬と臨牀.1972;21(7):1243-1248
6
竹島俊雄 他:診療と保険.1972;14(7):779-786
7
小池祐治 他:新薬と臨牀.1972;21(5):885-888
8
滝浪寿郎 他:眼科臨床医報.1972;66(10):1004-1007
9
川上 澄 他:診療と新薬.1973;10(3):621-626
10
金子仁郎 他:医学のあゆみ.1972;82(9):604-612
11
東 雄司 他:臨牀と研究.1972;49(10):2893-2898
12
小玉隆一 他:臨牀と研究.1973;50(4):1211-1215
13
佐久間有寿 他:診療と保険.1973;15(4):467-474
14
飯塚理八 他:産婦人科の世界.1973;25(6):673-680
15
藤田恵一:薬物療法.1973;6(8):1535-1541
16
村崎光邦:臨床精神医学.2000;29(増刊号):137-144
17
森 昌弘 他:日本薬理学雑誌.1972;68(3):314-329
18
Kamioka, T. et al.:Arzneimittel Forschung.1972;22(5):884-891