添付文書番号
1124008F1067_2_02
企業コード
672173
作成又は改訂年月
日本標準商品分類番号
871124
薬効分類名
不眠症治療薬
承認等
販売名
フルニトラゼパム錠1mg「アメル」
販売名コード
販売名英字表記
Flunitrazepam Tablets「AMEL」
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
フルニトラゼパム錠2mg「アメル」
販売名コード
販売名英字表記
Flunitrazepam Tablets「AMEL」
承認番号等
販売開始年月
貯法、有効期間
規制区分
一般的名称
フルニトラゼパム
禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
急性閉塞隅角緑内障の患者
[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
重症筋無力症の患者
[重症筋無力症の症状を悪化させるおそれがある。]
組成・性状
組成
フルニトラゼパム錠1mg「アメル」
有効成分 | 1錠中、日局フルニトラゼパム 1mgを含有する。 |
|---|
添加剤 | 乳糖水和物、結晶セルロース、低置換度ヒドロキシプロピルセルロース、青色1号、含水二酸化ケイ素、タルク、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、カルナウバロウ |
|---|
フルニトラゼパム錠2mg「アメル」
有効成分 | 1錠中、日局フルニトラゼパム 2mgを含有する。 |
|---|
添加剤 | 乳糖水和物、結晶セルロース、低置換度ヒドロキシプロピルセルロース、青色1号、含水二酸化ケイ素、タルク、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、カルナウバロウ |
|---|
製剤の性状
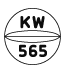
フルニトラゼパム錠1mg「アメル」
| 剤形 | 割線入りフィルムコーティング錠 |
|---|
| 色調 | 帯青白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 約7.1mm 大きさ(厚さ) 約2.7mm |
|---|
| 質量 | 約104mg |
|---|
| 識別コード | KW565/1 |
|---|
※フィルムコーティング内部(素錠)は青色
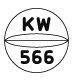
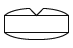
フルニトラゼパム錠2mg「アメル」
| 剤形 | 割線入りフィルムコーティング錠 |
|---|
| 色調 | 帯青白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 約8.1mm 大きさ(厚さ) 約4.0mm |
|---|
| 質量 | 約206mg |
|---|
| 識別コード | KW566/2 |
|---|
※フィルムコーティング内部(素錠)は青色
効能又は効果
用法及び用量
通常成人1回、フルニトラゼパムとして、0.5~2mgを就寝前又は手術前に経口投与する。
なお、年齢・症状により適宜増減するが、高齢者には1回1mgまでとする。
用法及び用量に関連する注意
不眠症には、就寝の直前に服用させること。また、服用して就寝した後、睡眠途中において一時的に起床して仕事等をする可能性があるときは服用させないこと。
重要な基本的注意
本剤の影響が翌朝以後に及び、眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、自動車の運転等の危険を伴う機械の操作に従事させないように注意すること。
連用により薬物依存を生じることがあるので、漫然とした継続投与による長期使用を避けること。本剤の投与を継続する場合には、治療上の必要性を十分に検討すること。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
肺性心、肺気腫、気管支喘息及び脳血管障害の急性期等で呼吸機能が高度に低下している患者
治療上やむを得ないと判断される場合を除き、投与しない。
投与する場合には、少量から投与を開始するなど注意すること。炭酸ガスナルコーシスを起こしやすい。
衰弱患者
少量から投与を開始するなど注意すること。
心障害のある患者
少量から投与を開始するなど注意すること。呼吸抑制があらわれやすい。
脳に器質的障害のある患者
少量から投与を開始するなど注意すること。作用が強くあらわれやすい。
腎機能障害患者
肝機能障害患者
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
妊娠動物(ラット)に投与した実験で、50mg/kgの用量で催奇形作用が認められている。
妊娠中に他のベンゾジアゼピン系化合物(ジアゼパム、クロルジアゼポキシド等)を服用していた患者が出産した新生児において、口唇裂、口蓋裂等が対照群と比較して有意に多いとの疫学的調査報告がある。
ベンゾジアゼピン系化合物で新生児に哺乳困難、嘔吐、活動低下、筋緊張低下、過緊張、嗜眠、傾眠、呼吸抑制・無呼吸、チアノーゼ、易刺激性、神経過敏、振戦、低体温、頻脈等を起こすことが報告されている。なお、これらの症状は、離脱症状あるいは新生児仮死として報告される場合もある。
また、ベンゾジアゼピン系化合物で新生児に黄疸の増強を起こすことが報告されている。
分娩前に連用した場合、出産後新生児に離脱症状があらわれることが、ベンゾジアゼピン系化合物で報告されている。
授乳婦
授乳を避けさせること。
ヒト母乳中へ移行することが報告されており、また、新生児の黄疸を増強する可能性がある。
ヒト母乳中へ移行し、新生児に嗜眠、体重減少等を起こすことが他のベンゾジアゼピン系化合物(ジアゼパム)で報告されている。
小児等
高齢者
少量から投与を開始するなど注意すること。運動失調、意識障害等の中枢神経抑制症状があらわれやすい。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
アルコール
(飲酒) | 中枢神経抑制作用が増強されるおそれがある。
アルコールとの併用は避けることが望ましい。 | ともに中枢神経抑制作用を有するため、相互に作用を増強するおそれがある。 |
中枢神経抑制剤 フェノチアジン誘導体
バルビツール酸誘導体
鎮痛薬
麻酔薬 等 | 中枢神経抑制作用が増強されるおそれがある。
アルコールとの併用は避けることが望ましい。 | ともに中枢神経抑制作用を有するため、相互に作用を増強するおそれがある。 |
モノアミン酸化酵素阻害剤 | クロルジアゼポキシドで舞踏病が発現したとの報告がある。 | 機序は不明である。 |
シメチジン | 本剤の中枢神経抑制作用が増強されるおそれがある。 | シメチジンが肝薬物代謝酵素(CYP3A4)を阻害するため本剤の血中濃度が上昇する。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
依存性(頻度不明)
連用により薬物依存を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。また、連用中における投与量の急激な減少ないし投与中止により、痙攣発作、せん妄、振戦、不眠、不安、幻覚、妄想等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。
刺激興奮、錯乱(いずれも頻度不明)
呼吸抑制(0.1%未満)、炭酸ガスナルコーシス(頻度不明)
呼吸機能が高度に低下している患者に投与した場合、炭酸ガスナルコーシスを起こすことがあるので、このような場合には気道を確保し、換気をはかるなど適切な処置を講ずること。
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。また、横紋筋融解症による急性腎障害の発症に注意すること。
悪性症候群(Syndrome malin)(頻度不明)
他の抗精神病薬等との併用により悪性症候群があらわれたとの報告がある。高熱、意識障害、高度の筋硬直、不随意運動、発汗、頻脈等があらわれることがあるので、このような場合には、本剤の投与中止、体冷却、水分補給、呼吸管理等の適切な処置を行うこと。
意識障害(頻度不明)
うとうと状態から昏睡等の意識障害があらわれることがあるので、注意すること。特に高齢者においてあらわれやすいので、慎重に投与すること。
一過性前向性健忘、もうろう状態(いずれも頻度不明)
本剤を投与する場合には少量から開始するなど、慎重に行うこと。なお、十分に覚醒しないまま、車の運転、食事等を行い、その出来事を記憶していないとの報告がある。
その他の副作用
| 1%以上 | 0.1~1%未満 | 0.1%未満 |
|---|
精神神経系 | ふらつき、眠気 | 頭痛、めまい、頭がボーッとする、運動失調、頭重 | 失調性歩行、不快感、焦躁感、不安感、しびれ感、耳鳴り、動作緩慢、酩酊感、振戦、構音障害、記憶力の低下 |
|---|
肝臓 | | AST、ALTの上昇 | Al-P、LDHの上昇 |
|---|
腎臓 | | | BUNの上昇 |
|---|
血液 | | | 白血球減少、血小板減少、貧血 |
|---|
循環器 | | | 動悸、血圧低下 |
|---|
消化器 | | 口渇 | 食欲不振、胃不快感、下痢、便秘、腹痛、嘔吐、舌のあれ、胸やけ、流涎、口の苦味 |
|---|
過敏症 | | | 発疹 |
|---|
その他 | 倦怠感 | 脱力感、尿失禁 | 発汗、いびき、顔面潮紅、顔面浮腫、頻尿、排尿困難 |
|---|
注)発現頻度は製造販売後調査を含む。
過量投与
症状
うとうと状態から昏睡等の中枢神経抑制作用に基づく症状
処置
本剤の過量投与が明白又は疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には、使用前にフルマゼニルの使用上の注意を必ず読むこと。
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
その他の注意
臨床使用に基づく情報
投与した薬剤が特定されないままにフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与された患者で、新たに本剤を投与する場合、本剤の鎮静・抗痙攣作用が変化、遅延するおそれがある。
薬物動態
血中濃度
生物学的同等性試験
フルニトラゼパム錠1mg「アメル」とサイレース錠1mgを、クロスオーバー法によりそれぞれ2錠(フルニトラゼパムとして2mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
薬物動態パラメータ(生物学的同等性)
| AUC(0→48)
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | T1/2
(hr) |
フルニトラゼパム錠1mg「アメル」 | 151.8±33.7 | 17.0±5.7 | 1.34±1.11 | α相4.5±1.5
β相19.3±14.5 |
サイレース錠1mg | 160.4±37.6 | 16.0±4.0 | 1.08±0.60 | α相5.0±1.7
β相15.3±7.1 |
血漿中未変化体濃度(生物学的同等性)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
PharmacokineticsEtc
フルニトラゼパム錠2mg「アメル」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成12年2月14日 医薬審第64号)」に基づき、フルニトラゼパム錠1mg「アメル」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた。
薬効薬理
作用機序
中枢における抑制性伝達物質GABAの受容体には、GABAA受容体とGABAB受容体があるが、GABAA受容体は、GABA結合部位、ベンゾジアゼピン結合部位、バルビツール酸誘導体結合部位、などからなる複合体を形成し、中央にCl-を通す陰イオンチャネル(Cl-チャネル)が存在する。GABAがその結合部位に結合するとCl-チャネルが開口し、それにより神経細胞は過分極し、神経機能の全般的な抑制がもたらされる。ベンゾジアゼピン系薬物がこの複合体の結合部位に結合すると、GABAによる過分極誘起作用すなわち神経機能抑制作用を促進する。
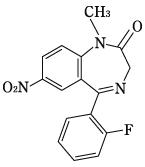
有効成分に関する理化学的知見
一般的名称
フルニトラゼパム(Flunitrazepam)
化学名
5-(2-Fluorophenyl)-1-methyl-7-nitro-1,3-dihydro-2H-1,4-benzodiazepin-2-one
分子式
C16H12FN3O3
分子量
313.28
性状
白色~微黄色の結晶性の粉末である。
酢酸(100)に溶けやすく、無水酢酸又はアセトンにやや溶けやすく、エタノール(99.5)又はジエチルエーテルに溶けにくく、水にほとんど溶けない。
化学構造式
融点
168~172℃
包装
〈フルニトラゼパム錠1mg「アメル」〉
100錠[10錠(PTP)×10]
1,000錠[10錠(PTP)×100]
1,000錠[瓶、バラ]
〈フルニトラゼパム錠2mg「アメル」〉
100錠[10錠(PTP)×10]
1,000錠[10錠(PTP)×100]
1,000錠[瓶、バラ]
主要文献
1
社内資料:生物学的同等性試験[錠1mg]
2
社内資料:生物学的同等性試験(溶出挙動比較)
3
第十八改正日本薬局方解説書. 廣川書店. 2021;C-4894
文献請求先及び問い合わせ先
保険給付上の注意
本剤は厚生労働省告示第97号(平成20年3月19日付)に基づき、投薬量は1回30日分を限度とされている。
製造販売業者等

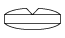


 0120-041-189
0120-041-189