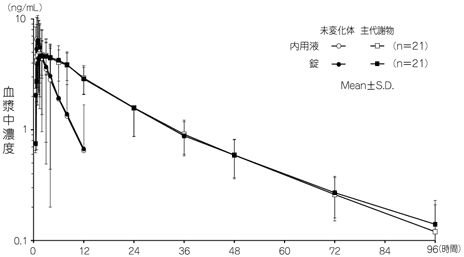
1
Hill RC, et al.:J Clin Psychopharmacol. 2000; 20: 285-286
2
Saito M, et al.:J Clin Psychopharmacol. 2005; 25: 527
3
Spina E, et al.:Ther Drug Monit. 2000; 22: 481-485
4
Mahatthanatrakul W, et al.:J Clin Pharm Ther. 2007; 32: 161-167
5
Jung SM, et al.:Clin Pharmacol Ther. 2005; 78: 520
6
社内資料:リスパダール内用液の配合変化
7
社内資料:リスペリドンのがん原性試験
8
社内資料:リスペリドンのがん原性試験
9
社内資料:リスペリドンの薬物動態の検討
10
社内資料:小児及び青年の精神疾患患者におけるリスペリドンの薬物動態の検討(2016年2月29日承認、CTD2.7.2.2)
11
Van Beijsterveldt, L, 山下知寛, 他:基礎と臨床. 1993; 27: 3053-3062
12
社内資料:リスペリドンの胎盤移行の検討
13
Nyberg S, et al.:Psychopharmacol. 1993; 110: 265-272
14
Mannens G, et al.:Psychopharmacol. 1994; 114: 566-572
15
Mannens G, et al.:Drug Metab and Dispos. 1993; 21: 1134-1141
16
Schotte A, et al.:Jpn J Pharmacol. 1995; 69: 399-412
17
社内資料:リスペリドンの代謝物の活性の検討
18
石郷岡純, 他:臨床評価. 1991; 19: 93-163
19
Snoeck E, et al.:Psychopharmacol. 1995; 122: 223-229
20
社内資料:経口リスペリドン製剤とカルバマゼピンとの相互作用の検討
21
社内資料:経口リスペリドン製剤とシメチジン及びラニチジンとの相互作用の検討
22
Spina E, et al.:Ther Drug Monit. 2004; 26: 386
23
D’Arrigo C, et al.:Pharmacol Res. 2005; 52: 497
24
Nakagami T, et al.:Clin Pharmacol Ther. 2005; 78: 43
25
社内資料:経口リスペリドン製剤とアミトリプチリンとの相互作用の検討
26
社内資料:経口リスペリドン製剤とエリスロマイシンとの相互作用の検討
27
社内資料:経口リスペリドン製剤とトピラマートとの相互作用の検討
28
社内資料:経口リスペリドン製剤とガランタミンとの相互作用の検討
29
社内資料:経口リスペリドン製剤とドネペジルとの相互作用の検討
30
社内資料:経口リスペリドン製剤とジゴキシンとの相互作用の検討
31
社内資料:経口リスペリドン製剤とバルプロ酸との相互作用の検討
32
社内資料:経口リスペリドン製剤とリチウムとの相互作用の検討
33
八木剛平, 他:臨床精神医学. 1991; 20: 529-542
34
八木剛平, 他:臨床精神医学. 1993; 22: 1059-1074
35
藤井康男, 他:臨床精神医学. 1993; 22: 101-116
36
稲永和豊, 他:神経精神薬理. 1993; 15: 617-631
37
八木剛平, 他:臨床医薬. 1993; 9: 2725-2739
38
平林良登, 他:臨床医薬. 1993; 9: 1453-1470
39
水木 泰, 他:神経精神薬理. 1993; 15: 749-762
40
石郷岡純, 他:臨床精神医学. 1994; 23: 507-522
41
村崎光邦, 他:臨床評価. 1993; 21: 221-259
42
工藤義雄, 他:臨床精神医学. 1994; 23: 233-294
43
社内資料:小児期の自閉性障害に伴う易刺激性を有する患者を対象とした国内第Ⅲ相試験(2016年2月29日承認、CTD2.7.2.2)
44
Janssen PAJ, et al.:J Pharmacol Exp Ther. 1988; 244: 685-693
45
Leysen JE, et al.:Mol Pharmacol. 1992; 41: 494-508
46
Megens A, et al.:J Pharmacol Exp Ther. 1992; 260: 146-159
47
菊本修, 他:薬物・精神・行動. 1993; 13: 39-42