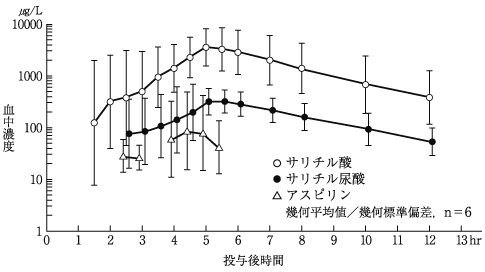
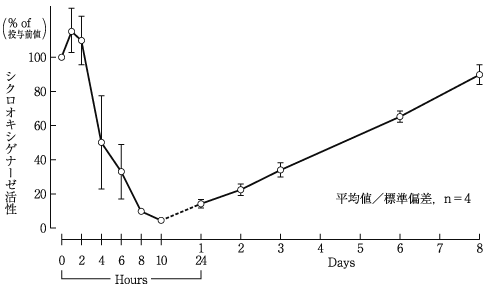
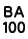1
Ryan TJ, et al.: J Am Coll Cardiol. 1996; 28: 1328-1419
2
厚生省医薬安全局: 医薬品等安全性情報. 1998; 151: 2-7
3
Sim SM, et al.: Br J Clin Pharmacol. 1991; 32: 17-21
4
社内資料: アスピリン腸溶錠の単回投与試験
5
社内資料: アスピリン腸溶錠(100mg, 300㎎)とアスピリン普通錠(100mg, 300㎎)との比較による相対的バイオアベイラビリティ試験
6
Fed Regist. 1998 Oct 23; 63: 56802-56818
7
Wilson JT, et al.: Clin Pharmacol Ther. 1978; 23: 635-643
8
Pütter J: International symposium on present state of acetylsalicylic acid in research and therapeutic application. 1982; 49-59
9
Ali M, et al.: Stroke. 1980; 11: 9-13
10
Jimenez AH, et al.: Am J Cardiol. 1992; 69: 258-262
11
Lewis Jr HD, et al.: N Engl J Med. 1983; 309: 396-403
12
Cairns JA, et al.: N Engl J Med. 1985; 313: 1369-1375
13
The RISC Group: Lancet. 1990; 336: 827-830
14
Ridker PM, et al.: Ann Int Med. 1991; 114: 835-839
15
Nyman I, et al.: Lancet. 1992; 340: 497-501
16
Juul Möller S, et al.: Lancet. 1992; 340: 1421-1425
17
ISIS-2 Collaborative Group: Lancet. 1988; Ⅱ: 349-360
18
Baigent C, et al.: Circulation. 1993; 88. I-291
19
ISIS-3 Collaborative Group: Lancet. 1992; 339: 753-770
20
ISIS-4 Collaborative Group: Lancet. 1995; 345: 669-685
21
Elwood PC, et al.: Br Med J. 1974; I: 436-440
22
The CDPR Group: J Chron Dis. 1976; 29: 625-642
23
Elwood PC, et al.: Lancet. 1979; Ⅱ: 1313-1315
24
Elwood PC, et al.: J R Coll Gen Pract. 1979; 29: 413-416
25
Breddin K, et al.: Haemostasis. 1980; 9: 325-344
26
The AMIS Research Group: Circulation. 1980; 62: V79-V84
27
The PARIS Research Group: Circulation. 1980; 62: 449-461
28
Fields WS, et al.: Stroke. 1977; 8: 301-316
29
Bousser MG, et al.: Stroke. 1983; 14: 5-14
30
The ESPS Group: Lancet. 1987; Ⅱ: 1351-1354
31
UK-TIA Study Group: Br Med J. 1988; 296: 316-320
32
The SALT Collaborative Group: Lancet. 1991; 338: 1345-1349
33
The Dutch TIA Trial Study Group: N Engl J Med. 1991; 325: 1261-1266
34
Karepov VG, et al.: Neurology. 1994; 44: 579S
35
IST Collaborative Group: Lancet. 1997; 349: 1569-1581
36
CAST Collaborative Group: Lancet. 1997; 349: 1641-1649
37
McEnany MT, et al.: J Thorac Cardiovasc Surg. 1982; 83: 81-89
38
Chesebro JH, et al.: N Engl J Med. 1984; 310: 209-214
39
Lorenz RL, et al.: Lancet. 1984; Ⅰ: 1261-1264
40
Goldman S, et al.: Circulation. 1988; 77: 1324-1332
41
Goldman S, et al.: Circulation. 1989; 80: 1190-1197
42
Henderson WG, et al.: Controlled Clinical Trials. 1995; 16: 331-341
43
Thornton MA, et al.: Circulation. 1984; 69: 721-727
44
Schwartz L, et al.: N Engl J Med. 1988; 318: 1714-1719
45
Taylor RR, et al.: Am J Cardiol. 1991; 68: 874-878
46
Sato N, et al.: Pediatr Int. 1999; 41: 1-7
47
草川三治他: 日小児会誌. 1983; 87: 2486-2491
48
Lecomte M, et al.: J Biol Chem. 1994; 269: 13207-13215
49
Smith WL, et al.: Curr Opin Invest Drugs. 1994; 3: 1-11
50
Gordon JL, et al.: Brit J Pharmac. 1978; 64: 481-483
51
鎮痛・下熱・抗炎症薬および痛風の治療に用いる薬物. グッドマン・ギルマン薬理書. 第10版. 廣川書店, 2003: 872-934