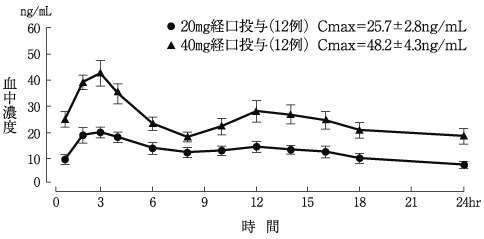
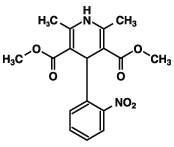
1
中道昇他: 薬理と治療. 1995; 23(Suppl. 2): 7-21
2
社内資料: 40mg1日1回投与で効果不十分な高血圧症患者を対象とした臨床薬理試験
3
Duhm B, et al.: Arzneim-Forsch/Drug Res. 1972; 22: 42-53
4
島本和明他: 薬理と治療. 1995; 23(Suppl. 2): 173-188
5
石井當男他: 薬理と治療. 1997; 25: 69-80
6
石井當男他: 薬理と治療. 1997; 25: 81-90
7
石井當男他: 薬理と治療. 1997; 25: 121-154
8
社内資料: 40mg1日1回投与で効果不十分な高血圧症患者を対象とした二重盲検比較試験
9
社内資料: 二重盲検比較試験から継続の長期継続投与試験
10
社内資料: 長期併用投与試験
11
加藤和三他: 薬理と治療. 1997; 25: 195-225
12
加藤和三他: 薬理と治療. 1997; 25: 227-257
13
Hayase S, et al.: Jpn Circulation J. 1971; 35: 903-914
14
橋本虎六他: 心臓. 1971; 3: 1294-1304
15
Kanazawa T, et al.: Arzneim-Forsch/Drug Res. 1974; 24: 1267-1274
16
Vater W.: 2nd International Adalat® Symposium. Springer. 1975; 77-81
17
Nayler WG, et al.: Am J Cardiol. 1980; 46: 242-248
18
Fleckenstein A, et al.: 5th International Adalat® Symposium. Excerpta Medica. 1983; 36-52
19
Kazda S, et al.: 5th International Adalat® Symposium. Excerpta Medica. 1983; 133-143
20
Pumphrey CW, et al.: Am J Cardiol. 1983; 51: 591-595
21
Taira N, et al.: 2nd International Adalat® Symposium. Springer. 1975; 40-48