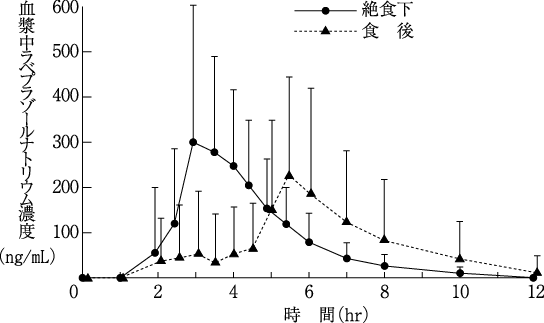
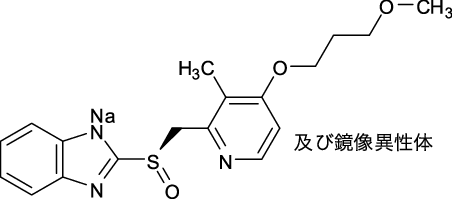
1
Yasuda, S., et al.: Int. J. Clin. Pharmacol. Ther., 1994;32(9):466-473 [PRT-0081]
2
社内資料:日本人健康成人男性を対象としたE3810の臨床薬理試験(2011)(2014年12月26日承認、CTD 2.7.6.1) [PRT-1342]
3
Yasuda, S., et al.:Clin. Pharmacol. Ther., 1995;58(2):143-154 [PRT-0154]
4
Ishizaki, T., et al. : Clin. Pharmacol. Ther., 1995;58(2):155-164 [PRT-0155]
5
Ishizaki, T., et al. : Aliment. Pharmacol. Ther., 1999;13(Suppl.3):27-36 [PRT-0212]
6
中澤三郎ら: Modern Physician, 1994;14(S.):38-68 [PRT-0090]
7
本村明ら: Modern Physician, 1994;14(S.):23-37 [PRT-0105]
8
篠村恭久ら: Modern Physician, 1994;14(S.):69-84 [PRT-0095]
9
八尾恒良ら: Modern Physician, 1994;14(S.):85-99 [PRT-0094]
10
中川充文ら: Modern Physician, 1994;14(S.):100-107 [PRT-0096]
11
吉田豊ら: Modern Physician, 1994;14(S.):108-115 [PRT-0097]
12
中野哲ら: Modern Physician, 1994;14(S.):116-123 [PRT-0100]
13
谷内昭ら: Modern Physician, 1994;14(S.):124-136 [PRT-0099]
14
吉田豊ら: Modern Physician, 1994;14(S.):137-147 [PRT-0098]
15
Kinoshita, Y., et al. : Am. J. Gastroenterol., 2012;107(4):522-530 [PRT-0910]
16
岩崎有良ら:薬理と治療,1999;27(4):705-712 [PRT-0205]
17
井上正規ら:内科宝函,1994;41(7):143-150 [PRT-0107]
18
Fujisaki, H., et al. : Biochem. Pharmacol., 1991;42(2):321-328 [PRT-0036]
19
Fujisaki, H., et al. : Drug Invest., 1991;3(5):328-332 [PRT-0039]
20
村上学ら:G. I. Research, 1993;1(5):493 [PRT-0038]
21
河合隆ら:G. I. Research, 1993;1(3):274-280 [PRT-0043]
22
藤崎秀明ら:日本薬理学雑誌,1993;102(6):389-397 [PRT-0035]
23
Morii, M., et al. : Biochem. Pharmacol., 1990;39(4):661-667 [PRT-0136]
24
村上学ら:G. I. Research, 1993;1(5):497-500 [PRT-0128]
25
社内資料:Effect of Rabeprazole Sodium on Aspirin induced Gastric Mucosal Lesion in Rats,2012 [PRT-1343]







 パリエット20
パリエット20