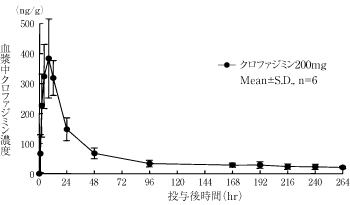
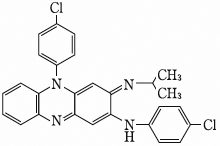
1
Schaad-Lanyi Z.et al.:Int.J.Lepr. 55(1),9(1987) [LAMM00615]
2
Mansfield R.E.:Am.J.Trop.Med.Hyg. 23(6),1116(1974) [LAMM00297]
3
Desikan K.V.et al.:Lepr.Rev. 47(2),107(1976)[LAMM00347]
4
Venkatesan K.et al.:Int.J.Lepr. 61(4)Suppl.,16A(1993)[LAMM00967]
5
Feng P.C.C.et al.:Drug Metab.Disposition 9(6),521(1981) [LAMM00441]
6
Feng P.C.C.et al.:Drug Metab.Disposition 10(3),286(1982) [LAMM00462]
7
Levy L.:Am.J.Trop.Med.Hyg. 23(6),1097(1974) [LAMM00294]
8
Morrison N.E.et al.:Int.J.Lepr. 44(1/2),133(1976) [LAMM00353]
9
Sarracent J.et al.:Int.J.Lepr. 52(2),154(1984) [LAMM00521]
10
Ito T.et al.:Int.J.Lepr. 54(4),724(1986) [LAMM00616]
11
Shepard C.C.et al.:Proc.Soc.exp.Biol.Med. 132,120(1969) [LAMS00002]
12
Van Rensburg C.E.J.et al.:Antimicrob.Agents Chemother. 21(5),693(1982) [LAMM00453]