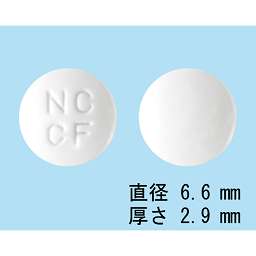
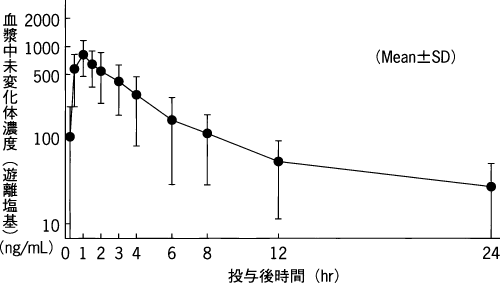
1
杉本孝一、他:臨床薬理. 1989;20(3):551-564
2
日本ケミファ株式会社:薬物動態に関する資料(社内資料)
3
荒川規矩男、他:臨床医薬. 1992;8(8):1909-1925
4
荒川規矩男、他:臨床医薬. 1992;8(8):1927-1940
5
荒川規矩男、他:臨床医薬. 1992;8(9):2095-2123
6
斉藤俊弘、他:臨床薬理. 1992;23(4):679-685
7
鏑木恒男、他:診療と新薬. 1992;29(7):1564-1571
8
横山正一、他:診療と新薬. 1992;29(7):1555-1563
9
竹田和義、他:臨床医薬. 1992;8(10):2507-2527
10
西川哲男、他:診療と新薬. 1992;29(7):1572-1590
11
東野一彌、他:診療と新薬. 1992;29(7):1525-1543
12
曽和亮一、他:診療と新薬. 1992;29(7):1544-1554
13
吉永 馨、他:臨床医薬. 1992;8(10):2467-2483
14
東野一彌、他:診療と新薬. 1992;29(7):1507-1524
15
國府達郎、他:臨床医薬. 1992;8(10):2485-2506
16
猿田享男、他:臨床医薬. 1992;8(9):2125-2145
17
林 博史、他:Therapeutic Research. 1992;13(8):3599-3614
18
小林 正、他:薬理と治療. 1992;20(9):3499-3516
19
日本ケミファ株式会社:薬効薬理に関する資料(社内資料)
20
西岡浩一郎、他:薬理と治療. 1992;20(5):1737-1745
21
S, G, Hastings. et al.:Arch int Pharmacodyn. 1977;226:81-99
22
I, Takayanagi. et al.:Gen Pharmac. 1987;18(1):87-89
23
K, Shiraishi. et al.:Gen Pharmac. 1992;23(5):843-845
24
日本ケミファ株式会社:薬効薬理に関する資料(社内資料)