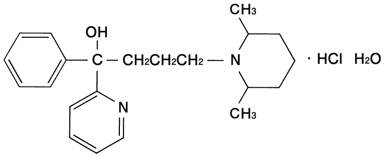
1
加藤 林也ほか:臨床薬理. 1992;23(2):495-505
2
新 博次ほか:臨床薬理. 1992;23(2):475-493
3
Hammill S. C. et al.:Clin Pharmacol Ther. 1982;32(6):686-691
4
坂井 誠ほか:心臓ペーシング. 1992;8(5):578-585
5
加藤 和三ほか:臨床医薬. 1992;8(5):1127-1148
6
松浦 秀夫ほか:臨床医薬. 1991;7(11):2471-2484
7
諸江 一男ほか:臨床医薬. 1992;8(1):123-139
8
北畠 顕ほか:臨床医薬. 1991;7(11):2451-2469
9
Mertz T. E. et al.:J Cardiovasc Pharmacol. 1980;2:527-541
10
Hashimoto K. et al.:Jpn J Pharmacol. 1988;48(2):273-282
11
Steffe T. J. et al.:J Pharmacol Exp Ther. 1980;214(1):50-57
12
Nitta J. et al.:J Cardiovasc Pharmacol. 1991;17(1):54-60
13
Sawanobori T. et al.:J Cardiovasc Pharmacol. 1990;16(6):975-983
14
Nakaya H. et al.:Jpn J Pharmacol. 1988;48(4):423-434
15
Hashimoto H. et al.:J. Electrocardiol. 1991;24(4):379-385
16
Reder R. F. et al.:Eur J Pharmacol. 1980;61:321-333
17
井野 威ほか:臨床薬理. 1991;22(4):745-756